题目内容
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)═2C3H5(ONO2)3(l)△H1
2H2(g)+O2(g)═2H2O(g)△H2
C(s)+O2(g)═CO2(g)△H3
则反应12CO2(g)+10H2O(g)+O2(g)+6N2(g)═4C3H5(ONO2)3(l)的△H为( )
A.12△H3+5△H2-2△H1 B.2△H1-5△H2-12△H3
C.12△H3-5△H2-2△H1 D.△H1-5△H2-12△H3
练习册系列答案
相关题目
17. 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.6kJ•mol-1
有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-890.3kJ•mol-1
③CH4(g)+CO2(g)═2CO(g)+2H2(g)△H3=247.3kJ•mol-1
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=250.3kJ•mol-1.
(2)恒温下,向一个2L的密闭容器中充入1molN2和2.6molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
①前20min的平均速率v(H2)为0.015mol/L•min.
②能提高反应中N2的平衡转化率的是BCE.
A.增加N2的浓度B.增加H2的量C.移出部分NH3D.提高反应温度
E.减小容器的容积F.加入合适的催化剂
(3)如图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,若t1时改变的条件是升高温度,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)D,化学平衡常数最大的一段时间是A.
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是减小压强.
(4)甲烷燃料电池(电解质溶液为KOH溶液)有广泛的应用.
①负极上发生的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②放电后,装置中溶液的pH变小.(填写“变大”、“变小”或“不变”)
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:(1)以天然气为原料制H2是合成氨的一条重要的路线.甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.6kJ•mol-1
有研究认为甲烷部分氧化的机理为:
②CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2=-890.3kJ•mol-1
③CH4(g)+CO2(g)═2CO(g)+2H2(g)△H3=247.3kJ•mol-1
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=250.3kJ•mol-1.
(2)恒温下,向一个2L的密闭容器中充入1molN2和2.6molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol/L) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②能提高反应中N2的平衡转化率的是BCE.
A.增加N2的浓度B.增加H2的量C.移出部分NH3D.提高反应温度
E.减小容器的容积F.加入合适的催化剂
(3)如图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程的曲线图,若t1时改变的条件是升高温度,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是(填写下列序号,下同)D,化学平衡常数最大的一段时间是A.
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
t4时改变的条件是减小压强.
(4)甲烷燃料电池(电解质溶液为KOH溶液)有广泛的应用.
①负极上发生的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②放电后,装置中溶液的pH变小.(填写“变大”、“变小”或“不变”)
14.化学与生产、生活、社会密切相关,下列说法错误的是( )
| A. | 高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一 | |
| B. | 大力发展新型电动汽车,可以减少燃油汽车的尾气排放量 | |
| C. | 生活中常用的蚕丝、棉花、淀粉、油脂等都是由高分子组成的物质 | |
| D. | 塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地且难以降解 |
1.下列物质的名称和化学式不相符的是( )
| A. | 铝土矿(Al2O3) | B. | 磁性氧化铁(FeO) | ||
| C. | 铁红(Fe2O3) | D. | 明矾[KAl(SO4)2•12H2O] |
10.下列有关热化学方程式的叙述正确的是( )
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知反应2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
13.下列图示对应的化学实验的基本操作,其中装置合理、操作规范的是( )
| A. | 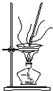 可用于除去碳酸钠固体中含有的少量碳酸氢钠 | |
| B. | 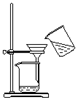 可用于碳酸钙固体和氯化钠溶液的分离 | |
| C. | 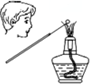 可正确观察钾元素焰色反应 | |
| D. | 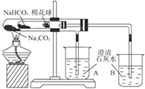 小试管中NaHCO3分解,(B)中澄清石灰水变浑浊,(A)中澄清石灰水没浑浊,说明稳定性Na2CO3>NaHCO3 |


