题目内容
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中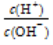 =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数KW=____________,该温度____________25 ℃。(填“>”、“=”或“<”)
(3) 在(2)所述温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合。若所得混合液的pH=10,则Va∶Vb=___________。
(4) 常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在答题卷的图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
下列物质分类的正确组合是
选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
B | NH3·H2O | 小苏打 | 氧化镁 | 二氧化氮 |
C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
已知25℃时,有关弱酸的电离平衡常数如下表:
化学式 | CH3COOH | HCN |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 |
下列有关说法正确的是( )
A.体积和pH相同的CH3COOH溶液与HCN溶液,分别与足量的Fe反应,HCN溶液产生的H2更多
B.体积和pH相同的CH3COOH溶液与HCN溶液,中和NaOH溶液所消耗NaOH的物质的量相同
C.amol·L-1HCN溶液加水稀释后,电离平衡常数减小,加入KCN晶体后,电离平衡常数增大
D.25℃时,在等浓度的CH3COOH溶液与HCN溶液中,水的电离程度前者大


 .该物质可能是钠的化合物 B.该物质一定含钠元素
.该物质可能是钠的化合物 B.该物质一定含钠元素 2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )
2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )