题目内容
某实验需要470mL0.4mol?L-1NaOH溶液,配制该溶液时,用托盘天平称取NaOH固体的质量应为( )
| A、8.0g | B、7.5g |
| C、4.0g | D、7.52g |
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:实验室中没有规格为470mL的容量瓶,配制溶液时需要选用500mL的容量瓶,实际上配制的是500mL 0.4mol?L-1的NaOH溶液,再根据m=cVM计算出需要称量的氢氧化钠的质量.
解答:
解:配制470mL氢氧化钠溶液,需要选用规格为500mL的容量瓶,
配制500mL 0.4mol?L-1的NaOH溶液,需要量取的氢氧化钠的质量为:m(NaOH)=40g/mol×0.4mol/L×0.5L=8.0g,
则配制该溶液时应称取的NaOH质量是:8.0g,
故选A.
配制500mL 0.4mol?L-1的NaOH溶液,需要量取的氢氧化钠的质量为:m(NaOH)=40g/mol×0.4mol/L×0.5L=8.0g,
则配制该溶液时应称取的NaOH质量是:8.0g,
故选A.
点评:本题考查了配制一定物质的量浓度的溶液方法及有关物质的量浓度的简单计算,题目难度不大,注意掌握配制一定浓度的溶液方法,明确实验室中容量瓶规格及配制过程中容量瓶规格的选用方法,能够根据所学知识解决简单的有关物质的量浓度的计算.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式的是( )
| A、NaHS溶液的水解方程式:HS-+H2O?H3O++S2- |
| B、足量的硫酸铝溶液与纯碱溶液反应:2A13++3CO32-+3H2O=2A1(OH)3↓+3CO2↑ |
| C、Fe(OH)3与足量的HI溶液反应:Fe(OH)3+3H+=Fe3++3H2O |
| D、向亚硫酸氢铵溶液中加入足量的NaOH溶液:NH4++OH-=NH3?H2O |
甲烷(CH4)与氧气(O2)以物质的量之比1:2混合时极易爆炸,关于该混合气体下列叙述正确的是( )
| A、分子数之比为 1:1 |
| B、原子数之比为5:4 |
| C、质量之比为1:1 |
| D、摩尔质量之比为1:4 |
下列说法不正确的是( )
| A、向AlCl3溶液中滴加氨水,产生白色沉淀,再加入盐酸,沉淀消失 |
| B、向铜粉中加入稀硫酸,铜粉不溶解;再加入Cu(NO3)2固体,铜粉溶解 |
| C、向BaCl2溶液中加入Na2SO3溶液,产生沉淀,再加入硝酸沉淀全部溶解 |
| D、向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 |
表示0.1mol/L NaHCO3溶液中有关粒子浓度的关系正确的是 ( )
| A、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| C、c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| D、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
选用一种试剂就能把失去标签的CCl4、苯、乙醇三种试剂区分开,则下列不可行的( )
| A、无水硫酸铜 |
| B、溴水 |
| C、水 |
| D、KMnO4溶液 |


 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2 的反应得到
的反应得到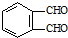 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式: