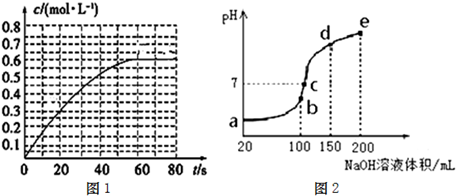
题目内容
| 微粒 | 电子数 | 质子数 | 中子数 | 质量数 | 原子结构示意图 |
| 1737Cl | |||||
| 818O |
考点:质量数与质子数、中子数之间的相互关系,质子数、中子数、核外电子数及其相互联系
专题:原子组成与结构专题
分析:根据原子符号中左下角数字为质子数,左上角数字为质量数,核电荷数=质子数=核外电子数,中子数=质量数-质子数,根据核外电子排布规律写出原子结构示意图.
解答:
解:1737Cl的质子数为17,质量数为37,电子数=质子数=17,中子数=37-17=20,原子结构示意图为:
 ;
;
818O的质子数为8,质量数为18,电子数=质子数=8,中子数=18-8=10,原子的结构示意图为 .
.
故答案为:
 ;
;818O的质子数为8,质量数为18,电子数=质子数=8,中子数=18-8=10,原子的结构示意图为
 .
.故答案为:
| 微粒 | 电子数 | 质子数 | 中子数 | 质量数 | 原子结构示意图 |
| 1737Cl | 17 | 17 | 20 | 37 |  |
| 818O | 8 | 8 | 10 | 18 |  . . |
点评:本题难度不大,考查学生对原子符号、原子结构示意图及其意义的理解,了解原子符号的意义是正确解题的关键.

练习册系列答案
相关题目
下列操作属于萃取的是( )
| A、向溴的煤油溶液里加入苯后振荡 |
| B、向溴水里加入酒精后振荡 |
| C、向硫的二硫化碳溶液里加水后振荡 |
| D、向碘水里加入四氯化碳后振荡 |
下列有关物质性质的比较,正确的是( )
| A、热稳定性:HF<HCl<HBr |
| B、微粒半径:O2->Mg2+>Cl- |
| C、第一电离能:Si>Al>Mg |
| D、电负性:Si>Al>Mg |
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“K2SO4”的分类不正确的是( )
| A、正盐 | B、氧化物 |
| C、钾盐 | D、硫酸盐 |