题目内容
3.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图所示的分离操作步骤流程图.图中圆括号内为加入的适当试剂,中括号内为采取的适当分离方法,方框内字母代表分离得到的有关物质的名称.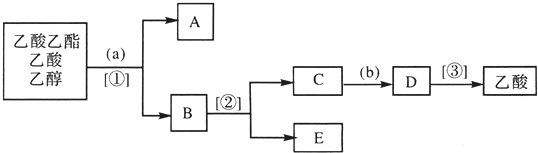
请填写:
(1)试剂:a.饱和的Na2CO3溶液,b.稀H2SO4.
(2)操作:①分液;②蒸馏;③蒸馏.
(3)分离所得物质的名称:
A乙酸乙酯,B乙醇、乙酸钠及过量的碳酸钠溶液,C乙酸钠溶液和Na2CO3溶液,D乙酸和硫酸钠溶液(及H2SO4),E乙醇.
分析 由分离乙酸乙酯、乙酸、乙醇的混合物的流程图可知,a为饱和碳酸钠溶液,①为分液,则得到A为乙酸乙酯,B为乙醇和乙酸钠,②为蒸馏,则E为乙醇,C为乙酸钠,b为盐酸,发生强酸制取弱酸的反应,D为醋酸和氯化钠,然后蒸馏得到乙酸,即③为蒸馏,以此来解答.
解答 解:乙酸呈酸性能与碱溶液或碳酸盐溶液反应,生成易溶于水的乙酸盐,经①分液的到A乙酸乙酯与B乙醇和乙酸钠和过量的碳酸钠溶液;再经②蒸馏除去乙醇,得到C乙酸钠和碳酸钠溶液,加入b稀硫酸酸化,再经③蒸馏得到乙酸.
(1)由上述分析可知,a为饱和的Na2CO3溶液,b为稀H2SO4,故答案为:饱和的Na2CO3溶液;稀H2SO4;
(2)由上述分析可知,①②③操作分别为分液、蒸馏、蒸馏,故答案为:分液;蒸馏;蒸馏;
(3)A、B、C、D、E分别为乙酸乙酯,乙醇、乙酸钠及过量的碳酸钠溶液,乙酸钠溶液和Na2CO3溶液,乙酸和硫酸钠溶液(及H2SO4),乙醇,
故答案为:乙酸乙酯;乙醇、乙酸钠及过量的碳酸钠溶液;乙酸钠溶液和Na2CO3溶液;乙酸和硫酸钠溶液(及H2SO4);乙醇.
点评 本题考查物质的分离、提纯等基本方法选择与应用,为高频考点,题目难度不大,注意物质的性质的异同及流程中的混合物分离方法为解答该类题目的关键.

练习册系列答案
相关题目
13.下列化学用语正确的是( )
| A. | 1 mol NaCl 分子 | |
| B. | 质子数为 35、中子数为 45 的溴原子:${\;}_{35}^{45}$ Br | |
| C. | 硫离子的结构示意图: | |
| D. | NH4+ 的电子式: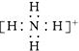 |
11. 己二酸
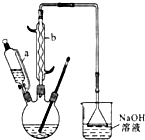
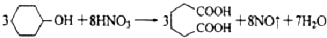
己二酸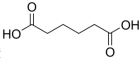 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
实验步骤如下;
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)仪器b的名称为球形冷凝管(或冷凝管).
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶 法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
 己二酸
己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
(1)仪器b的名称为球形冷凝管(或冷凝管).
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中.
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:2NO2+Na2CO3═NaNO2+NaNO3+CO2、NO+NO2+Na2CO3═2NaNO2+CO2.
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和苯洗涤晶体.
(5)粗产品可用重结晶 法提纯(填实验操作名称).本实验所得到的己二酸产率为75%.
18.用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应4HCl+O2$?_{400℃}^{CuO/CuCl_{2}}$2Cl2+2H2O可实现氯的循环利用.已知:
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.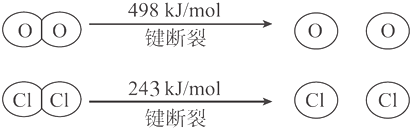
则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
Ⅰ.反应中,4 mol HCl被氧化放出115.6 kJ 的热量;
Ⅱ.

则断开1molH-O键与断开1molH-Cl键所需能量相差约为( )
| A. | 12kJ | B. | 32kJ | C. | 115.6kJ | D. | 127.6kJ |
8.某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子.某小组在实验室中用浸出萃取法制备硫酸铜:

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
(4)上述实验需要100mL0.5 mol•L-1的CuSO4溶液,配制时需称取12.5g CuSO4•5H2O(化学式量:250).

(1)操作Ⅰ为过滤.操作Ⅱ用到的玻璃仪器有烧杯、分液漏斗.
(2)操作Ⅱ、操作Ⅲ的主要目的是除杂、富集铜元素.
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液.多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4.
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80℃、200℃、300℃.
设计实验检验悬浊液成分,完成表中内容.
限选试剂:2mol•L-1 HCl、1mol•L-1 H2SO4、0.1mol•L-1 NaOH、0.1mol•L-1BaCl2、蒸馏水.仪器和用品自选.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,:加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
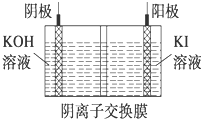 碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中.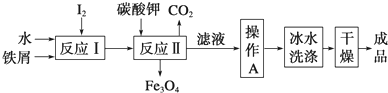
 .
. 、
、 .
.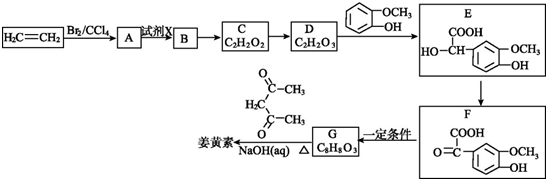
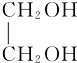 +O2$→_{△}^{Cu}$OHC-CHO+2H2O.
+O2$→_{△}^{Cu}$OHC-CHO+2H2O.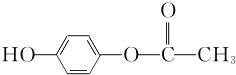 .
. .
.