题目内容
在密闭容器中进行的下列可逆反应:2A+3B 2C,△H<0,下列条件的改变一定可以加快正反应速率的是
2C,△H<0,下列条件的改变一定可以加快正反应速率的是
 2C,△H<0,下列条件的改变一定可以加快正反应速率的是
2C,△H<0,下列条件的改变一定可以加快正反应速率的是[ ]
①增加反应物A的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物C ⑤加入MnO2
A.②
B.①②⑤
C.全部
D.②③
A.②
B.①②⑤
C.全部
D.②③
A

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
一定条件下,工业上制取氨的反应为N2+3H2?2NH3.对于在密闭容器中进行的该反应,下列说法正确的是( )
| A、使用合适的催化剂,可使N2和H2都全部变成NH3 | B、达到平衡状态时,NH3的浓度一定是N2的2倍 | C、增大N2的浓度可使H2的转化率达到100% | D、反应不能进行到底,有一定的限度 |
(14分,每空2分) I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
I.合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2 (g)
(g)  2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是 _______(填序号,错选扣分)。
① 升高温度 ② 增大压强 ③ 使用催化剂 ④ 及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g) 2NH3(g),下列哪种情况下,
2NH3(g),下列哪种情况下,
说明该反应已经达到化学平衡状态____________________________________。
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1:3:2
④单位时间内每生成3mol H2的同时有2mol NH3生成
⑤3mol N-N键断裂,同时有6mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________________(选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入NH3的物质的量 |
| y | NH3的物质的量 | 平衡常数K | NH3的转化率 | 生成物物质的量总和 |
II.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+===I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| | 0.01mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol·L-1 Na2SO3溶液的体积/mL | H2O的体积 /mL | 实验 温度 /℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | --------- |
| 实验2 | 5 | 5 | 40 | 25 | ---------- |
| 实验3 | 5 | 5 | V2 | 0 | ----------- |
________________________________________________;
表中V1=___________mL.
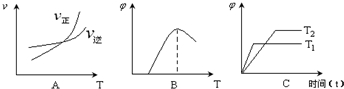
(2)可逆反应C(s)+H2O(g)
 H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率 与时间t的关系如右图。
与时间t的关系如右图。①图中t4到t6段时引起平衡移动的条件可能是
 ;
;②图中表示平衡混合物中CO的含量最高的一段时间是 。

 ).
). 2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )
2SO3,其正反应为放热反应.如果该反应是在密闭容器中进行的,下述有关说法中错误的是( )