题目内容
17.为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.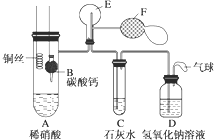
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气.其中第一步实验操作为B装置中CaCO3放入硝酸中.
(2)如何证明E中收集到的是NO而不是H2?将F气球中空气压入E中,有红棕色气体生成.
一段时间后,C中白色沉淀溶解,其原因是2HNO3+CaCO3═Ca(NO3)2+CO2↑+2H2O.
(3)装置D的作用是吸收多余的NO、NO2.
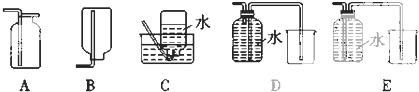
(4)以下收集一氧化氮气体的装置合理的是CD(填序号).
分析 实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色,且在C中可观察到浑浊,有碳酸钙沉淀生成,A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,以此解答该题.
解答 解:(1)实验时,可先将B装置中CaCO3放入硝酸中,碳酸钙和硝酸反应生成二氧化碳气体,先排出去其中的空气,以便在E烧瓶中收集到NO,以便观察颜色,
故答案为:B装置中CaCO3放入硝酸中;
(2)A中硝酸和铜反应生成NO,易于氧气反应,则将F气球中空气压入E中,有红棕色气体生成,如观察到红棕色,则说明生成NO而不是氢气,
生成二氧化氮通入C中生成硝酸,硝酸与碳酸钙反应,反应的化学方程式为2HNO3+CaCO3═Ca(NO3)2+CO2↑+2H2O,
故答案为:将F气球中空气压入E中,有红棕色气体生成;2HNO3+CaCO3═Ca(NO3)2+CO2↑+2H2O;
(3)装置D中盛有氢氧化钠溶液,可用与吸收二氧化氮气体,气体中气球可用于吸收不反应的NO,以防止污染空气,故答案为:吸收多余的NO、NO2;
(4)NO易与氧气反应,不能用排水法收集,一般用排水法收集,可用C、D装置,E的进气管太长,不能将水排出,故答案为:CD.
点评 本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,难度中等.

练习册系列答案
相关题目
14.有人认为目前已知化合物中数量最多的是有机化合物,下列关于其原因的叙述中不正确的是( )
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和叁键 | |
| D. | 多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合 |
8.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 |
12.下列有关化学用语表示错误的是( )
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: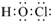 | |
| C. | 中子数为16的硫原子符号为:${\;}_{32}^{16}$S | |
| D. | Na+的离子结构示意图: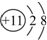 |
2.下列化学反应在冶金工业中没有得到广泛应用的是( )
| A. | MgCl2(熔融) $\frac{\underline{\;电解\;}}{\;}$ Mg+Cl2↑ | B. | Al2O3+3C $\frac{\underline{\;2125℃\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | HgS+O2$\frac{\underline{\;焙烧\;}}{\;}$ Hg+SO2 |
6.在下列溶液中,分别加入少量的二氧化锰粉末,可能发生反应的是( )
| A. | KI溶液 | B. | 酸性KI溶液 | C. | KOH 溶液 | D. | K2CO3 溶液 |
7.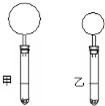 右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
 右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )
右下图是10mLpH均为2的盐酸和醋酸分别与足量的碳酸钙完全反应后,所观察到的实验现象(反应过程中产生的气体全部收集在试管上部的气球中).下列说法不正确的是( )| A. | 乙试管中盛放的是盐酸溶液 | |
| B. | 甲试管中盛放的是醋酸溶液 | |
| C. | 反应开始时的速率:甲>乙 | |
| D. | 反应结束时消耗碳酸钙的质量:甲>乙 |
 所示.
所示.
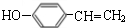 .
.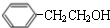 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$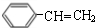 +H2O;C→D的反应类型为加成反应.
+H2O;C→D的反应类型为加成反应. .
. )的叙述正确的是B(填字母序号)
)的叙述正确的是B(填字母序号)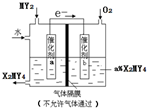 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题:
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题: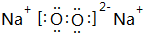 ;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.