题目内容
下列说法正确的是( )
| A、在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 |
| B、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
考点:焓变和熵变
专题:化学反应中的能量变化
分析:A、某些吸热反应也可以自发进行,依据△H-T△S<0分析判断;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行;
C、依据反应自发进行的判断依据△H-T△S<0分析;
D、催化剂改变反应速率不改变化学平衡;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行;
C、依据反应自发进行的判断依据△H-T△S<0分析;
D、催化剂改变反应速率不改变化学平衡;
解答:
解:A、某些吸热反应也可以自发进行,依据△H-T△S<0分析,△H>0,△S>0,常温下可以△H-T△S<0,如氢氧化钡晶体和氯化铵反应,是吸热反应,常温下可以蒸发进行,故A错误;
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行,NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H-T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,故C错误;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D错误;
故选B.
B、反应焓变大于0,熵变大于0,反应向熵变增大的方向进行,NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故B正确;
C、依据反应自发进行的判断依据△H-T△S<0分析,反应自发进行需要焓变、熵变和温度共同决定,故C错误;
D、催化剂改变反应速率不改变化学平衡,使用催化剂不可以改变化学反应进行的方向,故D错误;
故选B.
点评:本题考查了反应自发进行的分析判断,注意反应特征和焓变、熵变的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列不属于四种基本反应类型,但属于氧化还原反应的是( )
| A、Fe+H2SO4=FeSO4+H2↑ |
| B、CO+CuO═Cu+CO2↑ |
| C、Cu2(OH)2CO3═2CuO+H2O+CO2↑ |
| D、4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
下列叙述正确的是( )
| A、天然油脂的分子中含有酯基,属于酯类 |
| B、苯的分子式为C6H6,分子中的碳原子远远没有饱和,因此能和氯水发生加成反应 |
| C、所有卤代烃都难溶于水,且都是密度比水大的液体 |
| D、天然气与液化石油气的成分相同,与水煤气的成分不相同 |
下列实验操作合理的是( )
| A、用稀硫酸清洗做焰色反应的铂丝 |
| B、用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
| C、用100mL容量瓶配制50mL 0.1 mol?L-1的盐酸 |
| D、测NaOH熔点时可以将NaOH放入石英坩埚中高温熔化 |
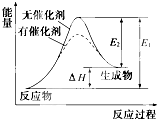 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A、催化剂能改变该反应的焓变 |
| B、催化剂能降低该反应的活化能 |
| C、该反应为放热反应 |
| D、逆反应的活化能大于正反应的活化能 |