题目内容
短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A、原子半径大小顺序:r(Z)>r(W)>r(X>)r(Y) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高价氧化物对应水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X原子的最外层电子数是其内层电子数的2倍,因此X是C,Y是地壳中含量最高的元素O,W与X同主族,W是Si,短周期元素Z2+与Y2-具有相同的电子层结构,电子层结构与Ne相同,因此Z为Mg,
A.同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
B.MgO中含有离子键,SiO2中含有共价键;
C.元素非金属性越强,最高价氧化物对应水化物的酸性越强,
D.元素非金属性越强,简单气态氢化物越稳定.
A.同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
B.MgO中含有离子键,SiO2中含有共价键;
C.元素非金属性越强,最高价氧化物对应水化物的酸性越强,
D.元素非金属性越强,简单气态氢化物越稳定.
解答:
解:X原子的最外层电子数是其内层电子数的2倍,因此X是C,Y是地壳中含量最高的元素O,W与X同主族,W是Si,短周期元素Z2+与Y2-具有相同的电子层结构,电子层结构与Ne相同,因此Z为Mg.
A.Mg和Si、C和O同周期,C和Si同主族,同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径r(Mg)>r(Si)>r(C)>r(O),故A正确;
B.Y分别与Z、W形成的化合物分别为MgO、SiO2,MgO中含有离子键,SiO2中含有共价键,化学键类型不同,故B错误;
C.C和Si同主族,非金属性C>Si,因此碳酸的酸性大于硅酸的酸性,故C错误;
D.非金属性O>Si,元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于SiH4,故D正确;
故选AD.
A.Mg和Si、C和O同周期,C和Si同主族,同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径r(Mg)>r(Si)>r(C)>r(O),故A正确;
B.Y分别与Z、W形成的化合物分别为MgO、SiO2,MgO中含有离子键,SiO2中含有共价键,化学键类型不同,故B错误;
C.C和Si同主族,非金属性C>Si,因此碳酸的酸性大于硅酸的酸性,故C错误;
D.非金属性O>Si,元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于SiH4,故D正确;
故选AD.
点评:本题考查原子结构与元素周期律知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意把握原子结构特征和对应单质、化合物的性质,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
下列说法错误的是( )
| A、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| B、利用丁达尔效应可以区别溶液与胶体 |
| C、质子数相同的粒子不一定是同一种元素 |
| D、1 mol CH4燃烧所放出的热量是CH4的燃烧热 |
下列叙述正确的是( )
| A、氢氧燃料电池中O2通入负极 |
| B、铅蓄电池在放电时,其负极的电极反应为:Pb-2e═Pb2+ |
| C、碱性锌锰电池在工作时,电解质中的OH-移向正极 |
| D、在海轮外壳镶嵌锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
以石化产品乙烯、丙烯为原料合成厌氧胶的流程如图:
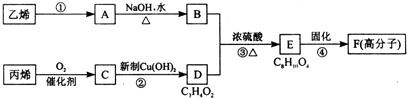
关于该过程的相关叙述正确的是( )

关于该过程的相关叙述正确的是( )
| A、反应④的反应类型是缩聚反应 |
| B、物质A是卤代烃 |
| C、物质B催化氧化后可以得到乙醛 |
| D、1 mol物质D最多可以消耗2 mol NaOH |
超临界流体(Supercritical Fluid)是温度和压力同时高于临界值的流体,也即压缩到具有接近液体密度的气体,是物质介于气态和液态之间的一种新的状态.目前应用最广的是超临界二氧化碳,在中药、香料的萃取分离以及作为溶剂、发泡剂取代氟利昂等具有重要价值.下列有关说法中错误的是( )
| A、超临界二氧化碳与CO2的物理性质不同,化学性质相同 |
| B、超临界二氧化碳可能是一种原子晶体 |
| C、用超临界二氧化碳溶解萃取物质,符合绿色化学的思想 |
| D、用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏 |
有关说法正确的是( )
| A、0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| B、常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
| C、NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42-) |
| D、0.1mol/L的NaHA溶液,其pH=4时:c(HA-)>c(H+)>c(H2A)>c(A2-) |