题目内容
下列表示化学反应对应的离子方程式正确的是( )
| A、Fe3O4与足量稀HNO3反应:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| B、玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═NaSiO3↓+H2O |
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
| D、往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.稀硝酸足量,亚铁离子被氧化成铁离子,反应中产生一氧化氮气体;
B.硅酸钠不属于难溶物,离子方程式中应该拆开,不能用沉淀符号;
C.双氧水具有强氧化性,能够将碘离子氧化成碘单质;
D.氢氧化钠少量,反应生成碳酸钙、氢氧化钠和水,不会有碳酸根离子剩余.
B.硅酸钠不属于难溶物,离子方程式中应该拆开,不能用沉淀符号;
C.双氧水具有强氧化性,能够将碘离子氧化成碘单质;
D.氢氧化钠少量,反应生成碳酸钙、氢氧化钠和水,不会有碳酸根离子剩余.
解答:
解:A.Fe3O4与足量稀HNO3反应生成硝酸铁、一氧化氮气体和水,正确的离子方程式为:3Fe3O4+28H++NO3-=NO↑+9Fe3++14H2O,故A错误;
B.玻璃试剂瓶被烧碱溶液腐蚀,生成的硅酸钠不是沉淀,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故B错误;
C.向双氧水中加入稀硫酸和KI溶液,反应生成碘单质和水,反应的离子方程式为:H2O2+2H++2I-═I2+2H2O,故C正确;
D.碳酸氢钙溶液中滴入少量氢氧化钠溶液,氢氧化钙过量,反应产物中不会有剩余的碳酸根离子,正确的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O,故D错误;
故选C.
B.玻璃试剂瓶被烧碱溶液腐蚀,生成的硅酸钠不是沉淀,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故B错误;
C.向双氧水中加入稀硫酸和KI溶液,反应生成碘单质和水,反应的离子方程式为:H2O2+2H++2I-═I2+2H2O,故C正确;
D.碳酸氢钙溶液中滴入少量氢氧化钠溶液,氢氧化钙过量,反应产物中不会有剩余的碳酸根离子,正确的离子方程式为:Ca2++OH-+HCO3-═CaCO3↓+H2O,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,属于中等难度的试题,注意掌明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列物质放在空气中,质量不会增加的是( )
| A、硫酸亚铁 | B、浓硝酸 |
| C、浓硫酸 | D、过氧化钠 |
1.6g某物质中含有6.02×1022个分子,则该物质的相对分子质量为( )
| A、16 | B、64 | C、32 | D、96 |
下列离子方程式书写正确的是( )
| A、铜和硝酸银反应:Cu+Ag+═Cu2++Ag | ||||
| B、NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | ||||
| C、稀HNO3中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | ||||
D、NH4Cl和NaOH的两浓溶液混合加热:NH4++OH-
|
下列叙述中,错误的是( )
| A、苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 |
| B、邻甲基苯酚、乙醇、苯甲酸在一定条件下均可以和金属钠反应放出氢气 |
| C、含醛基的化合物在发生化学反应时既可以被氧化又可以被还原 |
| D、甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
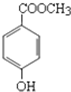 尼泊金酯是一种高效食品防腐剂,其结构简式为:
尼泊金酯是一种高效食品防腐剂,其结构简式为:
 化学反应的快慢和限度对人类生产生活有重要的意义.
化学反应的快慢和限度对人类生产生活有重要的意义.