题目内容
6.分子式为C4H10O并能被氧化生成醛类的有机化合物有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C4H10O并能被氧化生成醛类,则属于醇类,说明与羟基相连的碳上有2个氢原子,即具有-CH2OH结构的醇,根据同分异构体的知识来回答.
解答 解:丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,其中与羟基相连的碳上有2个氢原子的是:-CH2CH2CH2CH3、-CH2CH(CH3)2,所以该有机物的可能结构有2种,
故选A.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,利用烃基异构判断,比书写丁醇的同分异构体简单容易.

练习册系列答案
相关题目
19.乙醇和二甲醚在下列哪一种检测仪上显示出的信号是完全相同的( )
| A. | 质谱仪 | B. | 红外光谱仪 | C. | 元素分析仪 | D. | 核磁共振仪 |
1.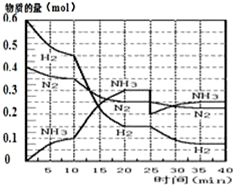 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
①此合成反应的a>0;△S>0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1.
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{(\frac{0.25mol}{2L})(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530kJ•mol-1.
11.无水氯化铝在生产、生活中应用广泛.
(1)将氯化铝水溶液加热蒸干并灼烧得到的固体产物是Al2O3.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如图:

已知:
①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是防止后续步骤生成的AlCl3水解或增大反应物的接触面积,加快反应速率(写出两种).
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质的反应方程式是Fe2O3+3C$\frac{\underline{\;950℃\;}}{\;}$2Fe+3CO↑.
③已知:
Al2O3(s)+3C(s)═2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)═2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol.
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为NaCl、NaClO、Na2CO3⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是除去FeCl3,提高AlCl3纯度.
⑥在Ⅰ至Ⅴ中涉及到氧化还原反应的有Ⅰ、Ⅱ、Ⅴ.
(1)将氯化铝水溶液加热蒸干并灼烧得到的固体产物是Al2O3.
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如图:

已知:
| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质的反应方程式是Fe2O3+3C$\frac{\underline{\;950℃\;}}{\;}$2Fe+3CO↑.
③已知:
Al2O3(s)+3C(s)═2Al(s)+3CO(g)△H1=+1344.1kJ•mol-1
2AlCl3(g)═2Al(s)+3Cl2(g)△H2=+1169.2kJ•mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)=2AlCl3(g)+3CO(g)△H=+174.9kJ/mol.
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为NaCl、NaClO、Na2CO3⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是除去FeCl3,提高AlCl3纯度.
⑥在Ⅰ至Ⅴ中涉及到氧化还原反应的有Ⅰ、Ⅱ、Ⅴ.
18.莽草酸结构简式如图.下列说法错误的是( )


| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
 如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下: