题目内容
15.已知下列热化学方程式:①Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H1
②Hg(l)+$\frac{1}{2}$O2(g)═HgO(s)△H2,
则反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H3中△H3的值为( )
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | -(△H1-△H2) |
分析 根据盖斯定律,利用已知的热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减.
解答 解:已知:①Zn(s)+$\frac{1}{2}$O2(g)=ZnO(s)△H1
②Hg(l)+$\frac{1}{2}$O2(g)=HgO(s)△H2
根据盖斯定律,①-②得Zn(s)+HgO(s)=ZnO(s)+Hg(l),
则△H3=△H1-△H2,
故选A.
点评 本题考查盖斯定律、反应热的计算等,难度中等,注意盖斯定律的理解与运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.东晋医药学家葛洪的《肘后备急方•治寒热诸疟方》记载有“青蒿一握,以水二升渍,绞取汁,尽服之”用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取的说法,说明不能加热青蒿,因高温可能使活性成分受损.中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是( )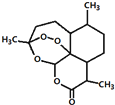

| A. | 用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取 | |
| B. | 能够发生水解反应 | |
| C. | 分子式为C15H23O5 | |
| D. | 青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关 |
20.下列实验操作中正确的是( )
| A. | 蒸发操作时,将蒸发皿中固体完全蒸干后停止加热 | |
| B. | 过滤操作时,直接将过滤液慢慢向漏斗中倾倒 | |
| C. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,温度计下端应插入液面下 |
4.下列说法中不 正确的是( )
| A. | 1 mol CH≡CH可以与Br2发生加成反应,消耗2 mol Br2 | |
| B. | 苯的邻位二元取代物只有一种可以说明苯分子不具有碳碳单键和碳碳双键的交替结构 | |
| C. | 2甲基戊烷的沸点高于己烷 | |
| D. | 用水可区分苯和溴苯 |
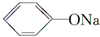 +CH3I→
+CH3I→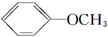 +NaI
+NaI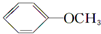 +HI→
+HI→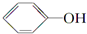 +CH3l
+CH3l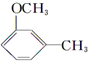 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$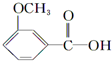
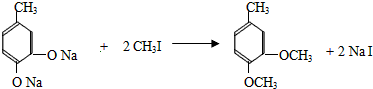 .
. .
.
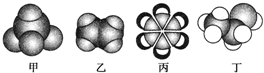
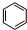 ,丁CH3CH2OH
,丁CH3CH2OH +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$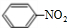 +H2O
+H2O