题目内容
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ.试写出丁烷燃烧的热化学方程式: .已知1mol液态水汽化时需要吸收44kJ热量,则反应C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(g)的△H= .
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为 极.若以稀硫酸为电解质溶液时,其正极反应式为 .
(3)已知:Fe(s)+
O2(g)═FeO(s)△H=-272.0kJ?mol-1;2Al(s)+
O2(g)═Al2O3(s)△H=-1675.7kJ?mol-1Al和FeO发生铝热反应的热化学方程式是 .
(4)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为 .
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为
(3)已知:Fe(s)+
| 1 |
| 2 |
| 3 |
| 2 |
(4)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为
考点:热化学方程式,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出;已知1mol液态水汽化时需要吸收44kJ热量,依据热化学方程式和盖斯定律计算得到;
(2)燃料电池依据原电池原理可知燃料做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)依据反应焓变=反应物键能总和-生成物键能总和计算焓变,标注物质狙击状态写出热化学方程式;
(2)燃料电池依据原电池原理可知燃料做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)依据反应焓变=反应物键能总和-生成物键能总和计算焓变,标注物质狙击状态写出热化学方程式;
解答:
解:(1)解:当10kg丁烷完全反应物质的量
=
mol,完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,2mol丁烷完全反应放热=
×5×105kJ=5800kJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
已知1mol液态水汽化时需要吸收44kJ热量,
①H2O(l)=H2O(g)△H=44kJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol;
C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(g)的△H=-2680KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol,-2680kJ/mol;
(2)燃料电池依据原电池原理可知,燃料丁烷做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水,正极电极反应为:O2+4e-+4H+=2H2O;
故答案为:负,O2+4e-+4H+=2H2O;
(3)①Fe(s)+
O2(g)═FeO(s)△H=-272.0kJ?mol-1
②2Al(s)+
O2(g)═Al2O3(s)△H=-1675.7kJ?mol-1
依据盖斯定律 ②-①×3得到:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol
故答案为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;
(4)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的反应焓变=(c+3a-6b)kJ/mol
热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=(-6b+c+3a)kJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=(-6b+c+3a)kJ/mol.
| 10000g |
| 58g/mol |
| 10000 |
| 58 |
| 2mol | ||
|
已知1mol液态水汽化时需要吸收44kJ热量,
①H2O(l)=H2O(g)△H=44kJ/mol;②2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
依据盖斯定律①×10+②得到2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g)△H=-5360kJ/mol;
C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(g)的△H=-2680KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol,-2680kJ/mol;
(2)燃料电池依据原电池原理可知,燃料丁烷做负极失电子发生氧化反应,氧气在正极得到电子发生还原反应生成氢氧化根离子在酸溶液中生成水,正极电极反应为:O2+4e-+4H+=2H2O;
故答案为:负,O2+4e-+4H+=2H2O;
(3)①Fe(s)+
| 1 |
| 2 |
②2Al(s)+
| 3 |
| 2 |
依据盖斯定律 ②-①×3得到:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol
故答案为:2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)△H=-859.7kJ/mol;
(4)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的反应焓变=(c+3a-6b)kJ/mol
热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=(-6b+c+3a)kJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=(-6b+c+3a)kJ/mol.
点评:本题考查了热化学方程式的书写方法和计算应用,题目难度中等,注意焓变计算和物质聚集状态的标注,焓变与键能计算关系,掌握基础是关键.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
下列离子方程式中正确的是( )
| A、碳酸钡和稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ |
| C、将CO2气体通入澄清石灰水中:CO2+Ca(OH)2═CaCO3↓+H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH+H++SO42-═BaSO4↓+H2O |
二氟甲烷(CH2F2)是性能优异的环保产品,试判断二氟甲烷的结构( )
| A、有4种 | B、有3种 |
| C、有2种 | D、有1种 |

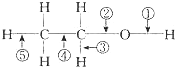 在乙醇的化学性质中,各反应的断键方式可概括如下:
在乙醇的化学性质中,各反应的断键方式可概括如下: