题目内容
16.五种短周期主族元素A、B、C、D、E的原子序数依次递增,A2属于绿色燃料,C的氧化物常用于玻璃的生产,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是( )| A. | 元素C、D、E的最高价氧化物对应水化物的酸性递减 | |
| B. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| C. | D、E简单离子的还原性顺序为:D>E | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
分析 五种短周期主族元素A、B、C、D、E的原子序数依次递增,A2属于绿色燃料,则A为H元素;C的氧化物常用于玻璃的生产,则C为Si元素;D元素原子的核电荷数是同主族上一周期元素的2倍,则D为S元素;E的原子序数大于S,则E为Cl元素;B、C为同周期元素,则B位于第三周期,B、D原子最外层电子数之和等于E的最外层电子数,则B最外层电子数=7-6=1,为Na元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知A为H、B为Na、C为Si、D为S、E为Cl元素,
A.非金属性Cl>S>Si,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故A错误;
B.非金属性Cl>S,元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.非金属性Cl>S,元素的非金属性越强,对应的阴离子的还原性越弱,则S、Cl简单离子的还原性顺序为S2->Cl-,故C正确;
D.S2-、Cl-比Na+多一个电子层,Na+半径最小,具有相同核外电子排布的离子,核电荷数越大离子半径越小,应为S2->Cl->Na+,故D错误.
故选C.
点评 本题考查了原子结构与元素周期律的关系,为高频考点,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.NA表示阿伏伽德罗常数的值,N代表离子数目,下列说法正确的是( )
| A. | 常温常压下,23gNO2和N2O4混合气体中含O原子数为NA | |
| B. | 1mol/L Al2(SO4)3溶液中含SO42-个数为3NA,含Al3+个数小于2NA | |
| C. | 在标准状况下,将22.4L SO3溶于水配成1L溶液,所得溶液中含SO42-个数为NA | |
| D. | 将1moL 氯气通入到足量水中,则N(HClO)+N(Cl-)+N(ClO-)═2NA |
4.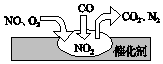 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
 随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
随着我国汽车年销量的大幅增加,空气环境受到了很大的污染.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )| A. | 反应中NO为氧化剂,N2为氧化产物 | |
| B. | 汽车尾气的主要污染成分包括CO、NO和N2 | |
| C. | NO和O2必须在催化剂表面才能反应 | |
| D. | 催化转化总化学方程式为2NO+O2+4CO=4CO2+N2 |
11.氢能的存储是氢能应用的主要瓶颈,开发新型储氢材料是氢能利用的重要研究方向,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
该氢化物的化学式为MgH2.
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为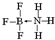 .
.
(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.
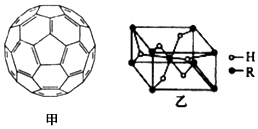
①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①基态Ti2+中含有的电子数为20,电子占据的最高能级是3d,该能级具有的原子轨道数为5.
②BH4-中的B原子的杂化方式是sp3.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+<(填“>”“<”或“=”)H-.
②某储氢材料是短周期金属元素M的氢化物,M的部分电离能如表所示:
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
(3)液氨是富氢物质,是氢能的理想载体.
①NH3的相对分子质量小于PH3,但NH3的沸点却远高于PH3,其原因是氨气分子之间可以形成氢键.
②NH3容易和分子中有空轨道的BF3反应形成新的化合物(用“→”表示配位键),该化合物的结构式为
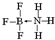 .
.(4)2008年,Yoon等人发现Ca与C60(分子结构如图甲)生成的Ca32C60能大量吸附H2分子.

①C60晶体易溶于苯、CS2,C60是非极性(填“极性”或“非极性”)分子.
②1mol C60分子中,含有σ 键数目为90NA个.(阿伏加德罗常数数值为NA)
(5)某金属氢化物储氢材料的晶胞结构如图乙所示,该金属氢化物的化学式为H2R.已知该晶体的密度为a g•cm-3,金属元素R的相对原子质量为M,阿伏加德罗常数数值为NA,则该晶胞的体积为$\frac{2M+4}{{a{N_A}}}$cm3.
1.设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
5.碳酸亚铁(FeCO3)是一种重要的工业盐.某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
①生成FeCO3离子方程式:Fe2++CO32-=FeCO3↓.
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因NaHCO3中存在电离平衡:HCO3-?H++CO32-,加FeSO4,Fe2++CO32-=FeCO3↓;平衡右移,H++HCO3-=CO2↑+H2O.
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
实验改进的意图是反应放出CO2,给反应创设无O2的环境.
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH.
(1)实验探究Ⅰ
| 实 验 Ⅰ | 操作 | 现象 |
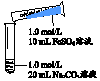 | 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
②反应过程中可能生成Fe(OH)2的依据是白色絮状变成灰绿色,最后变成红褐色.
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有Fe3+、Fe2+.
(2)实验探究Ⅱ
| 实验Ⅱ | 操作 | 现象 |
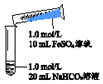 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多.支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,加足量稀硫酸沉淀均溶解,实验Ⅱ中产生的气体比实验Ⅰ中产生的气体多则结论成立.
(3)实验探究Ⅲ
| 实验Ⅱ | 操作 | 现象 |
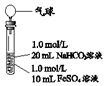 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
(4)综合以上实验,下列说法正确的是ad
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1L 1.0mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3.
6.用括号内的试剂或分离方法,除去下列各物质中少量的杂质或分离出物质,正确的是( )
| A. | 苯中的溴(碘化钾溶液) | B. | 汽油中的苯(水) | ||
| C. | 煤焦油中的苯、甲苯、二甲苯(分液) | D. | 甲烷中的乙烯(溴水) |
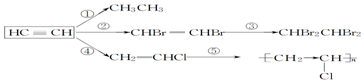
 ,加聚反应.
,加聚反应.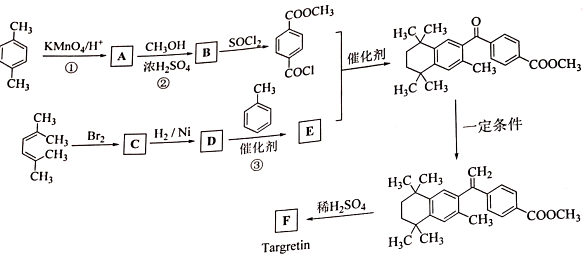
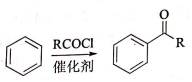 ②
②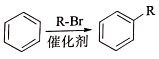
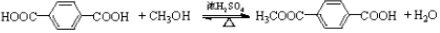 .
.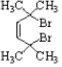 .
.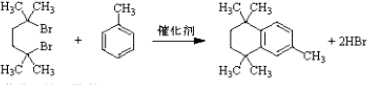 .
.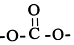 结构)
结构)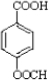 ,
,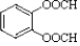 .
.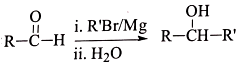 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)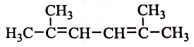 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).