题目内容
15.1g H2完全燃烧生成液态水放热142.9kJ,下列表示H2燃烧的热化学方程式正确的是( )| A. | 2H2+O2→2H2O+142.9kJ | B. | 2H2(g)+O2(g)→2H2O(l)+142.9kJ | ||
| C. | 2H2(g)+O2(g)→2H2O(l)+571.6kJ | D. | H2O(l)→H2(g)+$\frac{1}{2}$O2(g)-142.9kJ |
分析 根据热化学方程式的书写判断
书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:
(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号.
(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下.
(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“-”.△H的单位一般为kJ/mol.
(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数.
(5)△H与热化学方程式中化学式前面的化学计量数成正比.当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反.
(6)书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其他物质化学式前面的化学计量数.
(7)当两个热化学方程式相加(减)时,反应热同时相加(减),得到一个新的热化学方程式.
解答 解:A、物质的状态影响反应热,未注明物质的聚集状态,故A错误;
B、1g氢气燃烧生成液态水,放出142.9kJ热量,所以2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=-571.6kJ•mol-1,故B错误;
C、1g氢气燃烧生成液态水,放出142.9kJ热量,所以2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=-571.6kJ•mol-1,故C正确.
D、1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,则H2O(l)=H2(g)+$\frac{1}{2}$O2(g);△H=+285.8 kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法和注意问题,注意反应热化学方程式需要标注物质聚集状态,对应量的反应热,题目较简单.

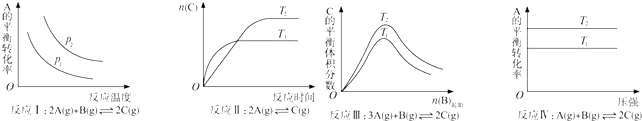
根据以上规律判断,上列结论正确的是( )
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H>0,T2<T1;或△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH -+H2↑ | |
| D. | 硫酸铝溶液与氨水反应:Al3++3 OH -═Al(OH)3↓ |


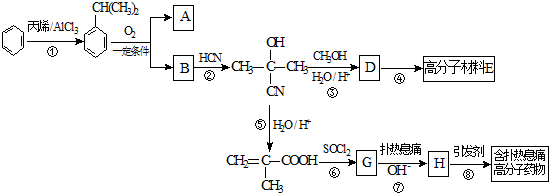
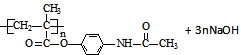
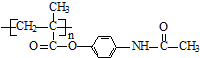 .
.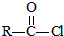
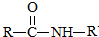 $\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2
$\stackrel{NaOH溶液}{→}$RCOONa+R′-NH2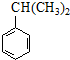 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式 .
.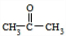 ;扑热息痛的结构简式为
;扑热息痛的结构简式为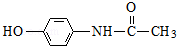 .
. →
→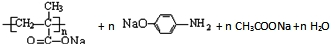 .
.