题目内容
14.可以将氧化还原反应2H2+O2=2H2O设计成原电池.(1)利用H2、O2、HCl溶液构成燃料电池,
正极的电极反应式为O2+4H++4eˉ=2H2O;
负极的电极反应式为2H2-4eˉ=4H+.
(2)把H2改成CH4,KOH溶液作电解质,则负极的电极反应式CH4+10OH--8e-=CO32-+7H2O,当导线中通过8mol电子时,需消耗2mol的KOH;将4mol CH4完全与Cl2发生取代反应,并生成等物质的量的四种氯代物,则理论上需要消耗Cl2的物质的量为10mol.
分析 (1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水;
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,正极上氧气得电子和水反应生成氢氧根离子;根据电池反应式中KOH和转移电子之间的关系式计算;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等.
解答 解:(1)酸性氢氧燃料电池中,负极上燃料失电子生成氢离子、正极上氧气得电子和氢离子反应生成水,正极反应为O2+4H++4eˉ=2H2O、负极反应为2H2-4eˉ=4H+,故答案为:O2+4H++4eˉ=2H2O;2H2-4eˉ=4H+;
(2)碱性甲烷燃料电池中,负极上甲烷失电子和氢氧根离子反应生成水和碳酸根离子,电极反应为CH4+10OH--8e-=CO32-+7H2O;电池反应式为CH4+2KOH+2O2=K2CO3+3H2O,根据KOH和转移电子之间的关系式得消耗n(KOH)=$\frac{8mol}{8}×2$=2mol;甲烷取代反应中,被取代H原子的物质的量与氯气的物质的量相等,生成等物质的量的四种氯代物,则生成四种氯代物的物质的量都是1mol,消耗氯气的物质的量=1mol×(1+2+3+4)=10mol,
故答案为:CH4+10OH--8e-=CO32-+7H2O;2;10.
点评 本题考查了原电池原理及物质的量的计算,根据溶液酸碱性书写电极反应式,注意烷烃发生取代反应时被取代氢原子与氯气的物质的量之比,为易错点.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
2.下列分子式表示的物质不具有同分异体的是( )
| A. | C3H7Cl | B. | C3H6 | C. | CF2Cl2 | D. | C4H6 |
6.下列叙述错误的是( )
| A. | 在18 g18O2中含有NA个氧原子 | |
| B. | 在氮原子中,质子数为7而中子数不一定为7 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | Cl-的结构示意图为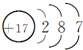 |
4.下列有关粒子的表示方法正确的是( )
| A. | 氨气分子的电子式: | B. | 硫原子结构示意图: | ||
| C. | KCl的电子式: | D. | H2O2的电子式: |
 ⑪
⑪ ⑫
⑫
 .
.