题目内容
下列化学用语正确的是( )
A、K+离子的结构示意图: |
B、四氯化碳的电子式: |
C、CH4分子的比例模型: |
| D、次氯酸的结构式:H-O-Cl |
考点:电子式、化学式或化学符号及名称的综合,原子结构示意图,球棍模型与比例模型
专题:
分析:A.钾离子的核电荷数为19,不是18;
B.氯原子的3对孤电子对不能省略;
C. 为甲烷的球棍模型,玻璃模型主要体现出各原子的相对体积大小;
为甲烷的球棍模型,玻璃模型主要体现出各原子的相对体积大小;
D.次氯酸分子的中心原子为O原子,分子中存在1个氧氢键和1个氧氯键.
B.氯原子的3对孤电子对不能省略;
C.
 为甲烷的球棍模型,玻璃模型主要体现出各原子的相对体积大小;
为甲烷的球棍模型,玻璃模型主要体现出各原子的相对体积大小;D.次氯酸分子的中心原子为O原子,分子中存在1个氧氢键和1个氧氯键.
解答:
解:A.钾离子的核电荷数为19,核外电子总数为18,其正确的离子结构示意图为: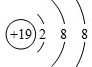 ,故A错误;
,故A错误;
B.四氯化碳为共价化合物,C、Cl原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为: ,故B错误;
,故B错误;
C.甲烷中碳原子比较大于H原子,CH4分子的比例模型为: ,故C错误;
,故C错误;
D.次氯酸分子中存在1个氧氢键和1个氧氯键,次氯酸的结构式为:H-O-Cl,故D正确;
故选D.
 ,故A错误;
,故A错误;B.四氯化碳为共价化合物,C、Cl原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为:
 ,故B错误;
,故B错误;C.甲烷中碳原子比较大于H原子,CH4分子的比例模型为:
 ,故C错误;
,故C错误;D.次氯酸分子中存在1个氧氢键和1个氧氯键,次氯酸的结构式为:H-O-Cl,故D正确;
故选D.
点评:本题考查化学用语的表示方法判断,题目难度中等,试题涉及电子式、结构简式、分子式等知识,把握化学用语的区别及规范应用为解答的关键,注重基础知识的考查.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列各组的电极材料和电解液,不能组成原电池的是( )
| A、铁棒 铁棒,稀硫酸 |
| B、铜片、石墨棒,硝酸银溶液 |
| C、锌片、铜片,稀盐酸 |
| D、铜片、银片,FeCl3溶液 |
下列叙述正确的是( )
| A、非金属原子间以共价键结合的物质都是共价化合物 |
| B、含有共价键的化合物都是共价化合物 |
| C、凡是能电离出离子的化合物都是离子化合物 |
| D、氮、氧、氟的氢化物分子间可以形成氢键 |
已知R2+离子核外有a个电子,b个中子.表示R原子组成正确的是 ( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列叙述正确的是( )
| A、1 mol CO2 的质量为44g/mol |
| B、CO2的摩尔质量为44g |
| C、CO2的摩尔质量等于CO2的相对分子质量 |
| D、NA个CO2分子的质量(以克为单位)与CO2的相对分子质量在数值上相同 |
 分子式为
分子式为 其分子式为
其分子式为