题目内容
已知:常温下,0.01mol/LMOH溶液的pH为10,MOH(aq)与H2SO4(aq) 反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
在一定温度下,10mL 0.40mol·L-1H2O2溶液发生催化反应分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol﹒L-1﹒min-1
B.6~10min的平均反应速率:v(H202)<3.3×10-2mol﹒L-1min-1
C.反应至6min时,c(H2O2)=0.30mol﹒L-1
D.反应至6min时,H2O2分解了50%


 N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下: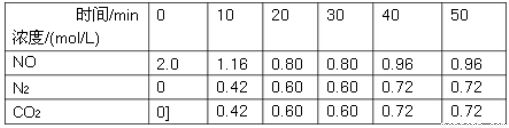
 HCO3-+OH-平衡。下列说法不正确的是
HCO3-+OH-平衡。下列说法不正确的是
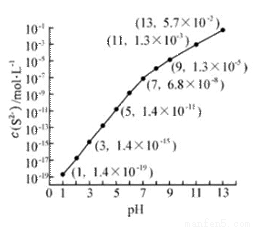
 2SO3(g)(Q>0)
2SO3(g)(Q>0)
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是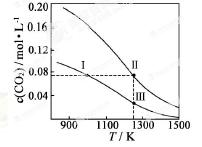
 是
是