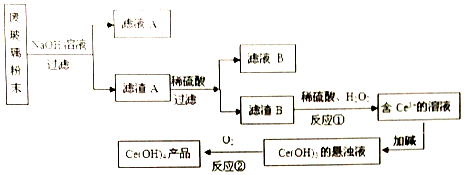
题目内容
6.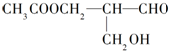 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与新制的氢氧化铜作用 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与H2作用 |
分析 某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,结合官能团的变化分析碳原子连接的不同基团即可解答.
解答 解:A.与甲酸发生酯化反应,-CH2OH生成HCOOCH2-,反应后生成的物质中C原子仍连接4个不同的原子或原子团,具有光学活性,故A不选;
B.与新制的氢氧化铜作用,-CHO与氢氧化铜溶液反应生成-COONa,仍具有手性碳原子,故B不选;
C.与甲酸发生酯化反应,-CH2OH生成HCOOCH2-,反应后生成的物质中C原子仍连接4个不同的原子或原子团,具有光学活性,故C不选;
D.在催化剂存在下与H2作用,醛基被还原生成羟基,则反应后生成的物质中C原子上连接两个相同的-CH2OH原子团,不具有光学活性,故D选.
故选D.
点评 本题以手性碳考查有机物的结构与性质,为高考常见题型和高频考点,注意把握醛、酯、醇的性质是解答的关键,注意体会官能团与性质的关系,题目难度不大.

练习册系列答案
相关题目
6.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | pH=1的溶液中:Na+、Cu2+、Cl-、CO32- | |
| B. | 0.1 mol•L-1 AlCl3溶液中:Cu2+、Mg2+、SO42-、NO3- | |
| C. | 由水电离产生的c(H+)=10-12 mol•L-1的溶液中:NH4+、SO42-、HCO3-、Cl- | |
| D. | 1.0mol/LKNO3溶液中:Fe2+、H+、Cl-、SO42- |
7.下列关于有机化合物的说法错误的是( )
| A. | 石油分馏是物理变化,可获得汽油、煤油、柴油等产品 | |
| B. | C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构) | |
| C. | 淀粉和纤维素水解的最终产物不同 | |
| D. | 由乙酸生成乙酸乙酯属于取代反应 |
14.下面关于硅的叙述中,正确的是( )
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
11.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 mL 1 mol/L的FeCl3溶液完全生成Fe(OH)3胶体,其胶粒数目为0.1 NA | |
| B. | 7.8 gNa2O2中含有的离子总数目为0.4 NA | |
| C. | 标准状况下,44.8 L HF所含分子数为2 NA | |
| D. | 标准状况下,80 gSO3中所含的原子数为4 NA |
18.下列关于有机物结构或性质说法正确的是( )
| A. | 乙烯的结构式为CH2=CH2 | |
| B. | CH2Cl2属于正四面体的空间结构 | |
| C. | 乙炔是含碳量最高的烃 | |
| D. | 正戊烷分子中所有碳原子一定不在同一条直线上 |
15.根据下列实验及其现象,所得出的结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | 非金属性:Cl>C>S |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO32-中的一种或几种 |
| C | 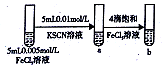 | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 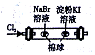 | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |