题目内容
在一定温度下,反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )
分析:通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答该题.
解答:解:A.反应速率之比应该等于系数比,单位时间里生成n molA2,同时生成n molAB时,不能说明正逆反应速率相等,故A错误;
B.通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,故B错误;
C.容器内各组分的物质的量不随时间的变化而变化,就说明了该反应达到平衡状态,故C正确;
D.无论该反应是否达到平衡状态,消耗nmolB2的同时一定生成2nmolAB,故D错误.
故选C.
B.通过化学方程式可知,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,容器的压强都不变,故B错误;
C.容器内各组分的物质的量不随时间的变化而变化,就说明了该反应达到平衡状态,故C正确;
D.无论该反应是否达到平衡状态,消耗nmolB2的同时一定生成2nmolAB,故D错误.
故选C.
点评:本题考查化学平衡状态的判断,题目难度不大,本题易错点为B,注意反应前后气体的化学计量数关系.

练习册系列答案
相关题目
将1mol A(g)和2mol B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+2B(g)?C(g)+D(g)△H<0,C的体积分数随时间变化如图l中曲线a所示 下列说法正确的是( )
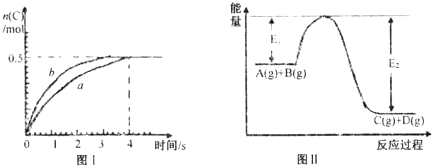

| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
