题目内容
15.某有机物B的分子式为C4H4O4,其结构简式为HOOCCH=CHCOOH(1)B分子所含官能团的名称是羧基、碳碳双键.
(2)B分子有4个不饱和碳原子.
(3)与B具有相同官能团的同分异构体的结构简式是(HOOC)2C=CH2.
分析 有机物结构简式为HOOCCH=CHCOOH,含-COOH、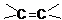
解答 解:(1)含有的官能团有羧基、碳碳双键,故答案为:羧基;碳碳双键;
(2)有机物的中的C原子分别形成C=C、C=O键,都为不饱和碳原子,共4个,故答案为:4;
(3)与B的具有相同官能团的同分异构体含有羧基、碳碳双键,为(HOOC)2C=CH2,故答案为:(HOOC)2C=CH2.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、-COOH的性质及检验的考查,题目难度不大.

练习册系列答案
相关题目
3. 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,Na原子核外有4 种不同的能级.
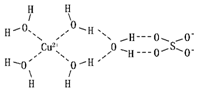
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
 1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
1915年诺贝尔物理学奖授予HenryBragg和LawrenceBragg,以表彰他们用X射线对晶体结构的分析所作的贡献.(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KC1 | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均采用虚线表示.
①实验证明,用蒸汽密度法测得的H2O的相对分子质量比用化学式计算出来的相对分子质量要大,原因是水分子间存在氢键,氢键会使水分子成为缔合水分子,所以计算出来的相对分子质量较大.
②SO42-中S原子的杂化类型是sp3,与其互为等电子体的离子有ClO4-、PO43-(任写两种)
③已知[Cu( NH3)4]2+具有对称的空间构型,[Cu( NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,用[Cu(NH3)4]2+的空间构型为平面正方形
④写出基态Cu2+的外围电子排布式3d9;金属钢采用面心立方堆积方式,已知Cu原子的半径为r pm,NA表示阿伏加徳罗常数,金属铜的密度是$\frac{4×64}{{N}_{A}(2\sqrt{2}r×1{0}^{-10})^{3}}$ g/cm3(列出计算式).
10.主族元素镓(Ga)的原子结构示意图是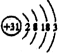 ,下列关系不正确的是( )
,下列关系不正确的是( )
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH) 3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
20.常温下,下列说法正确的是( )
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
7.下列各项中描述一和描述二都正确的是( )
| 描述一 | 描述二 | |
| A | 淀粉和纤维素互为同分异构体 | 乙酸和乙酸乙酯互为同系物 |
| B | 金刚石和石墨互为同素异形体 | O2和O3互为同位素 |
| C | SO2和NO2都属于大气污染物 | pH小于7的雨水就属于酸雨 |
| D | 正反应活化能小于逆反应活化能的反应属于放热反应 | 反应物能量总和大于生成物能量总和的反应属于放热反应 |
| A. | A | B. | B | C. | C | D. | D |
4. 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
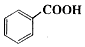 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$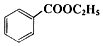 +H2O
+H2O
已知:
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL 环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在65〜70℃加热回流2h.反应时环己烷一乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210〜213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
(1)在该实验中,圆底烧瓶的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是防爆沸,使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)骤②中应控制馏分的温度在C.°
A.215〜220℃B.85〜90℃C.78〜80℃D.65〜70℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤④中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为92.12%.
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O已知:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL 环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在65〜70℃加热回流2h.反应时环己烷一乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210〜213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
(1)在该实验中,圆底烧瓶的容积最适合的是C(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是防爆沸,使用分水器不断分离除去水的目的是使平衡不断地向正向移动.
(3)骤②中应控制馏分的温度在C.°
A.215〜220℃B.85〜90℃C.78〜80℃D.65〜70℃
(4)步骤③加入Na2CO3的作用是除去苯甲酸乙酯中的苯甲酸;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是在苯甲酸乙酯中有未除净的苯甲酸,受热至100℃时升华.
(5)关于步骤④中的萃取分液操作叙述正确的是AD
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为92.12%.
