题目内容
17.电离常数是衡量弱电解质电离程度强弱的物理量.已知:化学式电离常数(25℃)HCNK=4.9×10-10,CH3COOHK=1.8×10-5 H2CO3 K1=4.3×10-7、K2=5.6×10-11 一氯乙酸K=1.4×10-3
(1)25℃时,有等浓度的:①NaCN溶液,②Na2CO3溶液,③CH3COONa溶液,三溶液的pH由大到小的顺序为②>①>③.(填序号)
(2)向NaCN溶液中通入少量的CO,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(3)图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是B.

分析 (1)根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
(2)根据电离常数大小分析反应的生成物;
(3)由乙酸(甲、Ka=1.8×10-5)和一氯乙酸(乙、Ka=1.4×10-3)可知,乙酸的Ka小,则乙酸的酸性弱;等浓度时酸性强的电离度大;弱酸的浓度越大,其电离度越小,以此来解答.
解答 解:(1)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,
故答案为:②>①>③;
(2)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(3)由乙酸(甲、Ka=1.8×10-5)和一氯乙酸(乙、Ka=1.4×10-3)可知,乙酸的Ka小,则乙酸的酸性弱;
由图可知,横坐标为浓度,纵坐标为电离度,则等浓度时酸性强的电离度大,即乙的曲线在上方,可排除A、C;
弱酸的浓度越大,其电离度越小,则曲线甲、乙均随浓度的增大而下降,可排除D,显然只有B符合,
故答案为:B.
点评 本题考查盐类水解的应用,溶液中离子浓度的大小比较,弱电解质的电离,综合性较强,要注意碳酸是二元弱酸分步电离,第二部电离比HCN小,把握Ka与酸性的关系、弱酸的电离度与浓度的关系及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
7.心酮胺是治疗冠心病的药物,它的结构简式如下所示:
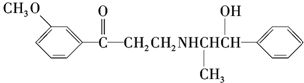
下列关于心酮胺的描述,错误的是( )
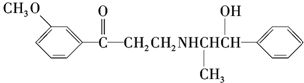
下列关于心酮胺的描述,错误的是( )
| A. | 可以在催化剂作用下和溴发生取代反应 | |
| B. | 可以和银氨溶液发生氧化反应 | |
| C. | 可以和氢溴酸发生取代反应 | |
| D. | 可以和浓硫酸与浓硝酸的混合液发生取代反应 |
8.有关如图所示化合物的说法不正确的是( )


| A. | 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 可以催化加氢,1 mol该物质最多可与7 mol H2反应 | |
| D. | 该化合物有4种官能团,可以使酸性KMnO4溶液褪色 |
5.甲苯(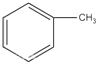 )的一氯代物有( )种,其中,取代在苯环上的有( )种.
)的一氯代物有( )种,其中,取代在苯环上的有( )种.
 )的一氯代物有( )种,其中,取代在苯环上的有( )种.
)的一氯代物有( )种,其中,取代在苯环上的有( )种.| A. | 3 2 | B. | 4 3 | C. | 5 4 | D. | 6 4 |
13.某学生对SO2与漂粉精的反应进行实验探究:
(1)写出C12和Ca(OH)2制取漂粉精的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是验证Cl2是否存在;
②由实验a、b不能判断白雾中含有HC1,理由是与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4
②用离子方程式解释现象iii中黄绿色褪去的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(4)测定漂粉精有效成分的质量分数.称取2.000g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000mol•L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3C1O-+I-═3C1-+IO3-IO3-+5I-+3H2O═6OH-+3I2
实验测得数据如下表所示.
该漂白粉中有效成分的质量分数为7.15%.
| 操作 | 现象 |
| 取适量漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝,后褪色 |
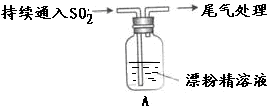 | 液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(2)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是验证Cl2是否存在;
②由实验a、b不能判断白雾中含有HC1,理由是与硝酸酸化的AgNO3产生的白色沉淀也可能是Ag2SO4或Ag2SO3;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4
②用离子方程式解释现象iii中黄绿色褪去的原因:SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(4)测定漂粉精有效成分的质量分数.称取2.000g漂粉精于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.2000mol•L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点.反应原理为:3C1O-+I-═3C1-+IO3-IO3-+5I-+3H2O═6OH-+3I2
实验测得数据如下表所示.
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
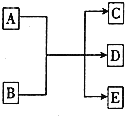 在一定条件下,物质A~E的转化关系如图所示,其中A为单质,常温下E为无色液体.
在一定条件下,物质A~E的转化关系如图所示,其中A为单质,常温下E为无色液体.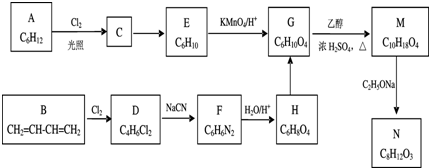
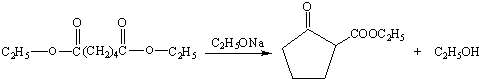
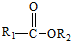 +
+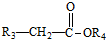 $\stackrel{C_{2}H_{5}ONa}{→}$
$\stackrel{C_{2}H_{5}ONa}{→}$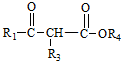 +R2OH
+R2OH .
. .
.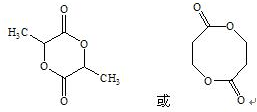 .
.
 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$ (R或R′可以是烃基或H原子)
(R或R′可以是烃基或H原子) .
. .
.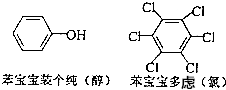 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如右图所示).则苯酚的二氯代物同分异构体数目是( )
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如右图所示).则苯酚的二氯代物同分异构体数目是( )