题目内容
9.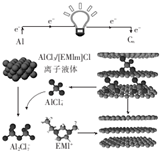 英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )
英国《自然》杂质近期报道了一种用泡沫石墨烯(CW)作为正极材料的新型铝离子电池,其放电时的工作原理如图所示,下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为CW(AlCl4)+e-═CW+AlCl4- |
分析 由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为CW[AlCl4]+e-=CW+AlCl4-,电解时阳极发生氧化反应,电解方程式为CW+AlCl4--e-═CW[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,以此解答该题.
解答 解:A.放电时,铝是活泼的金属铝是负极,被氧化生成Al2Cl7-,当有1mol电子转移时,消耗$\frac{1}{3}$molAl,负极质量减轻9g,故A正确;
B.充电时,石墨烯发生的反应为CW+AlCl4--e-═CW[AlCl4],故石墨烯作阳极,故B正确;
C.充电时,阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,故C错误;
D.放电时,石墨烯为正极,正极反应为CW[AlCl4]+e-=CW+AlCl4-,故D正确;
故选C.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,为高频考点,侧重学生的分析能力的考查,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.

练习册系列答案
相关题目
6.经过长时间的努力已经可以解决部分的污染问题,例如可降解塑料的问世,聚二氧化碳塑料就是其中的佼佼者,有关聚二氧化碳塑料的说法正确的是( )
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为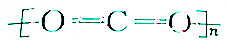 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
20.如图为通过手持技术实时测量冰醋酸稀释过程中电导率和温度的变化曲线,下列关于弱电解质溶液电离过程的说法错误的是( )
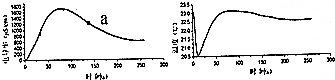

| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
17.用NA表示阿伏德罗常数的数值,下列说法正确的是( )
| A. | 常温下,1mol•L-1的Na2CO3溶液中CO32-的数目小于NA | |
| B. | 常温常压下,1.7g NH3中所含的原子数为0.4NA | |
| C. | 向含0.1mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为0.4NA | |
| D. | 标准状况下,4.48LNO2与足量的水反应,转移的电子数为0.1NA |
4.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 大力推广燃煤发电以满足工业发展的用电需求 | |
| B. | 加强生活污水的除磷处理,遏制水体的富营养化 | |
| C. | 实施化石燃料脱硫硝技术,减少大气污染物的排放 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
14. 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.
(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
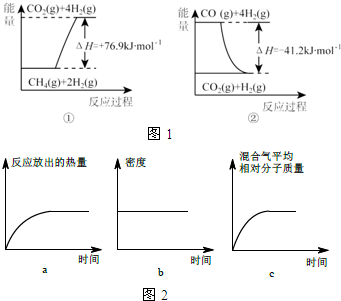
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是氮气和氢气合成氨的反应正向为放热反应并且是体系压强减小的反应,升高温度平衡逆向移动;增大压强,平衡正向移动.
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).
 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用.(1)工业以甲烷为原料生产氨气的过程如下:甲烷$\stackrel{Ⅰ}{→}$氢气$\stackrel{Ⅱ}{→}$氨气
①过程Ⅰ中,有关化学反应的能量变化如图1所示
反应①为吸热反应(填“吸热”或“放热”),CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol.
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为:[Cu(NH3)2CH3COO](aq)+CO(g)+NH3(g)?[Cu(NH3)2]CH2COO•CO(1),所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是b.(选填字母).
a.高温、高压 b.高温、低压 c.低温、低压 d.低温、高压
③如表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n (N2)=0.1mol,
n (H2)=0.3mol.图2图象能正确表示该过程中相关量的变化的是ab.(选填字母).
1.下列说法或表示方法不正确的是( )
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
18.下列指定条件下,离子方程式书写正确的是( )
| A. | 铜片投入FeCl3溶液中:3Cu+2Fe3+═2Fe+3Cu2+ | |
| B. | AgCl悬浮液中加入Na2S溶液沉淀变黑:2AgCl+S2-═Ag2S+2Cl- | |
| C. | 用两根铁电极电解CuSO4溶液:2Cu 2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+ | |
| D. | Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
 .
.