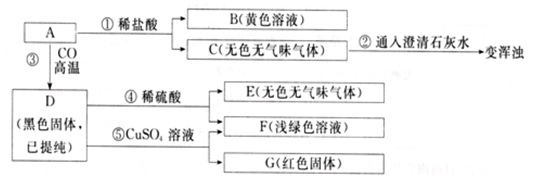
题目内容
11.在标准状况下16.8g CO和CO2的混合气体,体积为11.2L.则:(1)混合气体的密度是1.5g/L.
(2)混合气体的平均摩尔质量是33.6g/mol.
分析 (1)结合ρ=$\frac{m}{V}$计算;
(2)结合n=$\frac{V}{Vm}$、M=$\frac{m}{n}$计算.
解答 解:(1)混合气体的密度是$\frac{16.8g}{11.2L}$=1.5 g/L,故答案为:1.5 g/L;
(2)标准状况下Vm=22.4L/mol,混合3气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,混合气体的平均摩尔质量是$\frac{16.8g}{0.5mol}$=33.6 g/mol,故答案为:33.6 g/mol.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.在自然界中既能以游离态存在又能以化合态存在的元素是( )
| A. | 铝 | B. | 硅 | C. | 硫 | D. | 氯 |
7.五倍子是一种常见的中草药,其有效成分为X.在一定条件下X可分别转化为Y、Z.
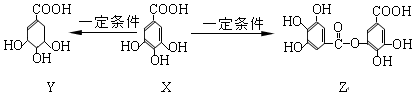
下列说法错误的是( )

下列说法错误的是( )
| A. | 1molZ最多能与7molNaOH发生反应 | |
| B. | 1molX最多能与2molBr2发生取代反应 | |
| C. | Y分子结构中有3个手性碳原子 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
6.已知H 2A为弱酸,下列说法错误的是( )
| A. | 0.1mol/L的Na 2A溶液中:c(A 2-)+c(HA -)+c(H 2A)=0.1mol/L | |
| B. | 常温下,将pH=3的H 2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 | |
| C. | 常温下,将pH=3的H 2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 | |
| D. | 常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na +)-c(HA -)-c(A 2-)=10 -5-10 -9 |
16.下列解释事实的方程式不正确的是( )
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 碳酸钠溶液显碱性:CO32-+H2O?HCO3-+OH- | |
| C. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3+3H+ | |
| D. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ |
3.下列说法正确的是( )
| A. | 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀 | |
| B. | 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用 | |
| C. | H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023 | |
| D. | 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱 |
20.下列说法正确的是( )
| A. | 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 | |
| B. | 室温下向1LpH=2的醋酸溶液中加水,所得溶液中H+数目减少,酸性减弱 | |
| C. | 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH值减小 |
1.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,Y的周期数等于其族序数.下列说法错误的是( )
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高价氧化物的水化物具有两性 | |
| B. | Z的最高价氧化物常温常压下为固体 | |
| C. | 气态氢化物的稳定性:X>W>Z | |
| D. | 原子半径:W>Z>Y |