题目内容
9.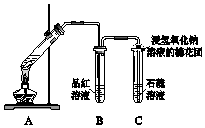 制备二氧化硫并研究其性质,如图所示.
制备二氧化硫并研究其性质,如图所示.(1)A中铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)B、C中的实验现象分别是B中品红溶液褪色、C中石蕊溶液变红.
(3)浸氢氧化钠溶液的棉花团的作用是吸收多余的二氧化硫气体,防止污染空气,反应的离子方程式是SO2+2OH-═SO32-+H2O.
分析 加热条件下,浓硫酸和铜发生反应生成二氧化硫,二氧化硫具有漂白性,可使品红褪色,二氧化硫和水反应生成的亚硫酸具有酸性,可使石蕊变红色,且可与碱反应,氢氧化钠溶液可用于吸收二氧化硫,防止污染环境,以此解答该题.
解答 解:(1)加热条件下,浓硫酸和铜发生反应生成二氧化硫,方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,可使品红褪色,二氧化硫和水反应生成的亚硫酸具有酸性,可使石蕊变红色,故答案为:B中品红溶液褪色; C中石蕊溶液变红;
(3)二氧化硫可与碱反应,氢氧化钠溶液可用于吸收二氧化硫,防止污染环境,反应的离子方程式为SO2+2OH-═SO32-+H2O,
故答案为:吸收多余的二氧化硫气体,防止污染空气;SO2+2OH-═SO32-+H2O.
点评 本题考查二氧化硫的化学性质,为高频考点,侧重考查学生的分析、实验能力,注意二氧化硫是酸性氧化物、具有还原性和漂白性,比较基础.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
19. 将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
 将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( ) | 选项 | 气体X | 溶液A及反应现象 | 结论 |
| A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生加成反应 |
| B. | 二氧化锰与浓盐酸共热产生的气体 | 紫色石蕊溶液最终褪色 | 氯气与水反应生成具有漂白性的物质 |
| C. | 碳酸钠固体与醋酸溶液反应产生的气体 | Na2SiO3溶液中出现白色沉淀 | 碳酸的酸性强于硅酸 |
| D. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
| A. | A | B. | B | C. | C | D. | D |
20.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①NaHSO4②Al2O3 ③NaHSO3 ④AgNO3.
①NaHSO4②Al2O3 ③NaHSO3 ④AgNO3.
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
17.下列物质常用作还原剂的是( )
| A. | 氢气 | B. | 硝酸 | C. | 氯气 | D. | 高锰酸钾 |
4.下列叙述正确的是(NA代表阿伏加德罗常数)( )
| A. | 将22.4 L HCl配成1 L溶液,c(H+)为1mol/L | |
| B. | 2 L 2 mol/L的盐酸,c(H+)为2 mol/L | |
| C. | 从100 mL 2 mol/L的盐酸取出10 mL,c(H+)为0.2 mol/L | |
| D. | 1 mol/L的盐酸中所含Cl-数目为NA |
14.下列各组物质间的反应与反应类型不相符的是( )
| A. | 乙烯与溴水(加成反应) | B. | 苯与浓硝酸(取代反应) | ||
| C. | 乙醇与乙酸(酯化反应) | D. | 乙醇与烧红的铜丝(取代反应) |
1.异丙苯是一种重要的有机化工原料.异丙苯的结构简式为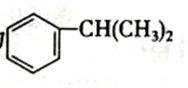
①异丙苯中至多有8个碳原子共平面
②异丙苯有多种同分异构体,其中一溴代物种类最少的芳香烃的是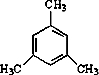 (填结构简式).
(填结构简式).
③由异丙苯制备对溴异丙苯的化学方程式为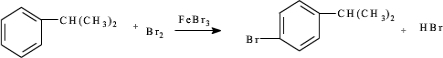 .
.

①异丙苯中至多有8个碳原子共平面
②异丙苯有多种同分异构体,其中一溴代物种类最少的芳香烃的是
 (填结构简式).
(填结构简式).③由异丙苯制备对溴异丙苯的化学方程式为
 .
.
16.不能区别食醋和白酒两瓶无色液体的方法是( )
| A. | 闻气味 | B. | 加入食盐 | C. | 加入废铁屑 | D. | 加入石灰石粉末 |
17.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA | |
| B. | 在反应KClO3+6HCl=KCl+3Cl2+3H2O中,每生成3molCl2转移的电子数为6NA | |
| C. | 含4molSi-O键的二氧化硅晶体中,氧原子数为2NA | |
| D. | 某密闭容器中盛有0.2molSO2和0.1molO2,在一定条件下充分反应,生成SO2的分子数为0.2NA |