题目内容
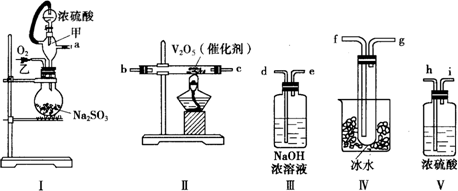
7.用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图1所示:
(1)在实验室中由粗盐“重结晶”的操作包括溶解、过滤、蒸发、过滤(填操作方法)、洗涤等步骤;有关其中“蒸发”步骤的叙述错误的是ac.
a.蒸发的目的是得到热饱和溶液 b.蒸发的目的是析出晶体
c.应用余热蒸干溶液 d.应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2•6H2O也需要蒸发,根据溶解度曲线(图2),蒸发的目的是a.
a.得到热饱和溶液 b.析出晶体
(3)若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:MgCl2•6H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)Cl+HCl↑+5H2O↑.
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取.若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色产生,则证明所得无水氯化镁晶体中不含氯化钠.
(5)MgCl2可电解制Mg,MgO是重要的耐火材料.在550℃时,MgCl2•6H2O会分解生成MgO、MgCl2、HCl和H2O,若不补充其他原料,使一定量的MgCl2•6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则a:b为3:1(取整数值).
分析 贝壳中含有CaCO3,煅烧贝壳得到CaO,发生的反应为CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO,CaO和水发生反应CaO+H2O=Ca(OH)2得到石灰乳;海水通过蒸发得到粗盐和母液,粗盐通过溶解、重结晶得到精盐;将石灰乳加入母液中发生反应Ca(OH)2+MgCl2=Mg(OH)2+CaCl2,将Mg(OH)2加入稀盐酸中,发生反应Mg(OH)2+2HCl=MgCl2+2H2O,然后浓缩得到MgCl2.6H2O,将MgCl2.6H2O在HCl氛围中加热得到MgCl2,再结合题目分析解答.
解答 解:贝壳中含有CaCO3,煅烧贝壳得到CaO,发生的反应为CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO,CaO和水发生反应CaO+H2O=Ca(OH)2得到石灰乳;海水通过蒸发得到粗盐和母液,粗盐通过溶解、重结晶得到精盐;将石灰乳加入母液中发生反应Ca(OH)2+MgCl2=Mg(OH)2+CaCl2,将Mg(OH)2加入稀盐酸中,发生反应 Mg(OH)2+2HCl=MgCl2+2H2O,然后浓缩得到MgCl2.6H2O,将MgCl2.6H2O在HCl氛围中加热得到MgCl2,
(1)在实验室中由粗盐“重结晶”制精盐的操作包括溶解、蒸发、过滤、洗涤等步骤;
a.氯化钠的溶解度受温度影响不大,所以蒸发的目的是析出晶体,故错误;
b.根据a知,蒸发的目的是析出晶体,故正确;
c.因为溶液中含有大量杂质,所以不能蒸干溶液,故错误;
d.应蒸发至有较多晶体析出时为止,因为溶液中含有大量杂质,所以不能蒸干溶液,否则得到的仍然是混合物,故正确;
故选ac;
故答案为:过滤;ac;
(2)由MgCl2溶液得到MgCl2•6H2O也需要蒸发,根据溶解度如图2曲线,蒸发的目的是得到热的饱和溶液,然后冷却得到MgCl2•6H2O,故选a,
故答案为:a;
(3)若在空气中加热MgCl2•6H2O,生成的是Mg(OH)Cl,根据反应物、生成物及反应条件知,该反应的化学方程式:MgCl2.6H2O=Mg(OH)Cl+HCl↑+5H2O,MgCl2易水解生成氢氧化镁和HCl,升高温度促进水解,所以得不到氯化镁而得到氢氧化镁,为抑制水解,需要在干燥的HCl气流中加热MgCl2•6H2O来得到MgCl2,
故答案为:MgCl2.6H2O=Mg(OH)Cl+HCl↑+5H2O;
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取.若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是利用焰色反应判断,用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色产生,则证明所得无水氯化镁晶体中不含氯化钠,
故答案为:用铂丝蘸取少量固体,置于酒精灯火焰上灼烧,若无黄色产生,则证明所得无水氯化镁晶体中不含氯化钠;
(5)假设是1molMgCl2•6H2O发生反应,根据Mg原子守恒得a+b=1mol①,盐酸的质量=1mol×203g/mol-amol×40g/mol-bmol×95g/mol=(203-40a-95b)g,HCl的物质的量=$\frac{(203-40a-95b)g×36.5%}{36.5g/mol}$=[(203-40a-95b)×1%]mol,根据Cl原子守恒得2mol=[2b+0.01×(203-40a-95b)]mol②,
联立①②得a=$\frac{108}{145}$,b=$\frac{37}{145}$,所以a:b=$\frac{108}{145}$:$\frac{37}{145}$=3:1,
故答案为:3:1.
点评 本题考查海水资源综合利用,涉及粗盐提纯、金属冶炼、盐类水解、物质的量的计算,侧重考查学生分析、计算能力,知道金属活泼性强弱与金属冶炼方法的关系,难点是(5)题计算,要根据原子守恒进行计算,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 28g CO和16g O2所含的原子数都为2NA | |
| B. | 300mL 2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| C. | 标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | |
| D. | 5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
| A. | CH4 | B. | C2H2 | C. | C2H4 | D. | C3H6 |
| A. | C2H4 | B. | C8H18(汽油的主要成分) | ||
| C. | C8H8 | D. | CHBrClCF3(一种麻醉剂) |
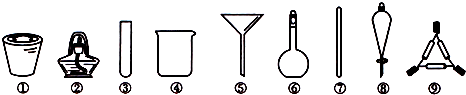
| A. | 将海带高温灼烧,选用①、②、⑨ | |
| B. | 过滤粗盐水,选用④、⑤、⑦ | |
| C. | 四氯化碳萃取溴水中的溴,选用④、⑥、⑧ | |
| D. | 加热碳酸氢钠固体并检验其产物,选用②、③ |
| A. | 浓盐酸 | B. | 氯化钠晶体 | C. | 浓氨水 | D. | 氢氧化钠固体 |