题目内容
12.把足量放锌放入盛有一定体积的稀硫酸的试管中,能使反应速率降低且不影响氢气产生量的因素是( )| A. | 加入少量CuSO4溶液 | B. | 加入少量K2SO4溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 将稀硫酸换为浓硫酸 |
分析 反应的实质是2Al+6H+=2Al3++3H2↑,铝足量,降低H+的浓度而不改变其物质的量,则可使反应速率降低且不影响H2产生量,以此解答.
解答 解:A.铝置换出铜,形成原电池反应,加快反应速率,故A错误;
B.加入适量K2SO4溶液,降低H+的浓度而不改变其物质的量,则可使反应速率降低且不影响H2产生量,故B正确;
C.加入适量的Na2CO3溶液,与盐酸反应,减少了氢气的生成,故C错误;
D.浓硫酸与锌反应不生成氢气,故D错误.
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,题目难度不大,注意把握影响化学反应速率的因素,本题特别要注意D项,浓硫酸具有强氧化性.

练习册系列答案
相关题目
2.CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:
(1)上述反应的逆反应是吸热(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)?2CO(g) K
C(s)+H2O (g)?H2(g)+CO(g) K1
CO(g)+H2O (g)?H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是K=$\frac{{K}_{1}}{{K}_{2}}$.
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)?H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为0.15mol•L-1•min-1,800℃时a=1.
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(mol•L-1)如表,其中达到平衡状态的是D(填字母).
未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)?H2(g)+CO2(g)的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
(2)已知在一定温度下:C(s)+CO2(g)?2CO(g) K
C(s)+H2O (g)?H2(g)+CO(g) K1
CO(g)+H2O (g)?H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是K=$\frac{{K}_{1}}{{K}_{2}}$.
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)?H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为0.15mol•L-1•min-1,800℃时a=1.
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(mol•L-1)如表,其中达到平衡状态的是D(填字母).
| A | B | C | D | |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
3.常温下,下列溶液中酸性最强的是( )
| A. | PH=4 | B. | C(H+)=1×10-3 mol•L-1 | ||
| C. | C(OH-)=1×10-12 | D. | C(H+)/C(OH-)=1012 |
17.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个进行沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
4.白磷与氧气可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:E(P-P)=a kJ•mol-1、E(P-O)=b kJ•mol-1、E(P=O)=c kJ•mol-1、E(O=O)=d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )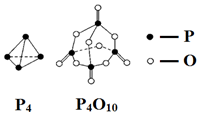

| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
1. 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
11.在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |