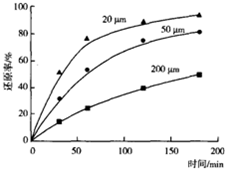
题目内容
8.高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下: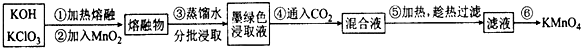
Ⅰ.(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是SiO2+2KOH=K2SiO3+H2O (用化学程式表示).
(2)第④步通人适量CO2,发生反应生成KMnO4和MnO2和碳酸盐,则发生反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2+2CO32-.
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是防止温度过高,KMn04受热分解.
(4)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,该反应中氧化产物与还原产物的物质的量之比为5:2.
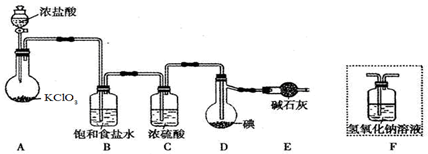
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
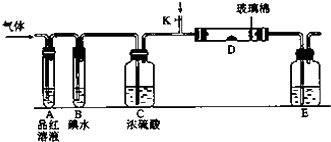
(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同?相同(填“相同”或“不相同”);
(6)若装置B中装有5.0mL l.0mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl.
(7)探究SO2的性质时,E装置中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为NaOH、Na2SO3、Na2SO4(以化学式作答).
分析 氢氧化钾和氯酸钾加热熔融加入二氧化锰得到熔融物,加入蒸馏水得到墨绿色浸取液,通入二氧化碳发生反应生成KMnO4和MnO2和碳酸盐,加热成热过滤得到滤液,滤液加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高得到高锰酸钾,
(1)熔融固体需要用铁坩埚熔融,瓷坩埚原料含有SiO2,能和碱反应,高温下与KOH发生反应;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2;
(3)KMnO4在加热的条件下会发生分解反应;
(4)向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色说明高锰酸钾做氧化剂氧化过氧化氢为氧气,依据电子守恒和原子守恒分析配平书写离子方程式;依据氧化还原反应中定量关系计算;
(5)根据SO2和Cl2的化学性质分析反应现象,从而判断反应现象是否相同;
(6)设碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得:a=+5,所以碘单质被氧化为HIO3,据此书写方程式;
(7)以NaOH溶液吸收尾气,NaOH溶液一定过量,SO2和NaOH反应产生亚硫酸钠,亚硫酸钠易被空气中的氧气氧化生成硫酸钠.
解答 解:Ⅰ.(1)由于KOH是强碱,在加热及高温时容易与玻璃、陶瓷中的SiO2发生反应,该反应的方程式为:SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O.所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行,故答案为:SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O;
(2)KOH、KClO3、MnO2共熔制得绿色K2MnO4,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-,故答案为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;
(3)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥.KMnO4受热容易发生分解反应:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.为了防止KMnO4的分解,所以在干燥时温度不宜过高,故答案为:防止温度过高,KMn04受热分解;
(4)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色,2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,氧化产物与还原产物的物质的量之比为5:2,故答案为:5:2;
Ⅱ.(5)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色,故答案为:相同;
(6)装置B中装有5.0mL1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,故I元素在氧化产物中的化合价为5.0×10-2/(0.005×1.0)=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3 ,故答案为:5Cl2+I2+6H2O=10HCl+2HIO3 ;
(7)以NaOH溶液吸收尾气,NaOH溶液一定过量,SO2和NaOH反应产生亚硫酸钠,亚硫酸钠易被空气中的氧气氧化生成硫酸钠,所以实验结束后,E装置中可能含有的溶质为NaOH、Na2SO3、Na2SO4,故答案为:NaOH、Na2SO3、Na2SO4.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应、工艺条件的控制等,题目难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

| A. | 铝片与盐酸反应生成氢气 | B. | 氢氧化铝溶于强碱溶液 | ||
| C. | 氢氧化铝溶于强酸溶液 | D. | 铝热反应 |
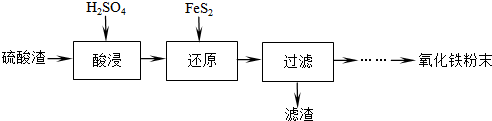
(1)“酸浸”中硫酸要适当过量,目的是提高铁的浸出率,抑制Fe3+的水解.
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO42-+16H+.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量.实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定.有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-;
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在酸式滴定管中(填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量偏高(填“偏高”、“偏低”或“不变”).
(4)①可选用KSCN(填试剂)检验滤液中含有Fe3+,产生Fe3+的原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
a.氧化:向溶液中加入过量的酸性高锰酸钾溶液,搅拌.
b.沉淀:滴加NaOH溶液,调节溶液为pH为3.2~3.8.
c.分离,洗涤.
d.烘干,研磨.
常见高铁酸钾的制备方法如下:
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
(2)某湿法制备高铁酸钾的基本流程及步骤如下:
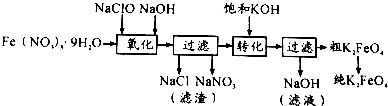
①控制反应温度为25℃,搅拌1.5h,经氧化等过程溶液变为紫红色,该反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O.
②在紫红色溶液中加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.沉淀过程中加入饱和KOH溶液得到晶体的原因是该温度下高铁酸钾的溶解度比高铁酸钠的溶解度小.
③K2FeO4粗产品含有Fe(OH)3、KCl等杂质,用重结晶方法进行分离提纯.其提纯步骤为:将一定量的K2FeO4粗产品溶于冷的3mol/LKOH溶液中,过滤,将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,搅拌、静置、过滤,用乙醇洗涤2~3次,在真空干燥箱中干燥.
④若以FeCl3 代替Fe(NO3)3作铁源,K2FeO4的产率和纯度都会降低.一个原因是在反应温度和强碱环境下NaCl的溶解度比NaNO3大,使得NaCl结晶去除率较低;另一个原因是Cl-被FeO42-氧化,消耗产品使产率降低.
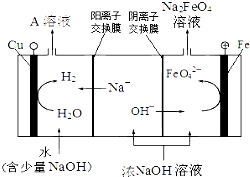
(3)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示:阳极的电极反应为Fe-6e-+8OH-=FeO42-+4H2O;其中可循环使用的物质的电子式是
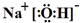 .
.
①NO(g)+Br2(g)?NOBr2(g)慢
②NO(g)+NOBr2(g)?2NOBr(g)快
下列有关该反应的说法正确的是( )
| A. | 反应速率主要取决于反应②的快慢 | B. | 反应速率v(NO)=v(NOBr)=2v(Br2) | ||
| C. | NOBr2是该反应的催化剂 | D. | 该反应的焓变等于akJ•mol-1 |
 .
.