题目内容
17.以下物质间的每步转化中,不能通过一步反应实现的是( )| A. | Na→Na2O2→NaOH→Na2CO3 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | Si→SiO2→Na2SiO3→H2SiO3 |
分析 A.Na点燃条件下与氧气反应生成Na2O2,然后与水反应生成NaOH,NaOH与二氧化碳反应生成Na2CO3;
B.Fe和盐酸反应生成FeCl2,FeCl2和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁和空气中的氧气水反应生成氢氧化铁;
C.Al与氧气反应生成Al2O3,氧化铝不能一步生成Al(OH)3;
D.硅和氧气反应生成二氧化硅,二氧化硅和氢氧化钠溶液反应生成硅酸钠溶液,硅酸钠溶液和盐酸反应生成硅酸沉淀.
解答 解:A.Na$\stackrel{O_{2}}{→}$Na2O2$\stackrel{H_{2}O}{→}$NaOH$\stackrel{CO_{2}}{→}$Na2CO3,能一步实现,故A不选;
B.Fe$\stackrel{HCl}{→}$FeCl2$\stackrel{NaOH}{→}$Fe(OH)2→$\stackrel{O_{2}+2H_{2}O}{→}$Fe(OH)3 ,能一步实现,故B不选;
C.Al$\stackrel{O_{2}}{→}$Al2O3,氧化铝不能一步反应生成氢氧化铝,故C选;
D.Si$\stackrel{O_{2}}{→}$SiO2$\stackrel{NaOH}{→}$Na2SiO3$\stackrel{HCl}{→}$H2SiO3 ,能一步实现,故D不选;
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于元素以及化合物的综合理解和运用的考查,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
20.将一定质量的锌、氧化铁、氧化铜的混合物粉末放入100mL4.4mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质锌的质量是( )
| A. | 2.60g | B. | 3.90g | C. | 6.50g | D. | 13.65g |
12.近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述.“绿色化学”要求从经济、环保和技术上设计可行的化学反应.据此,由单质铜制硝酸铜的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
| A. | Cu $\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | |
| B. | Cu $\stackrel{Cl_{2}}{→}$CuCl2 $\stackrel{NaOH溶液}{→}$Cu(OH)2 $\stackrel{稀HNO_{3}}{→}$ Cu(NO3)2 | |
| C. | Cu $\stackrel{O_{2}}{→}$CuO$\stackrel{稀HNO_{3}}{→}$ Cu(NO3)2 | |
| D. | Cu $\stackrel{浓H_{2}SO_{4}}{→}$CuSO4 $\stackrel{Ba(NO_{3})_{2}溶液}{→}$ Cu(NO3)2 |
2.化学与日常生活密切相关,下列有关说法不正确的是( )
| A. | 过氧化钠作供氧剂 | B. | 葡萄糖酸亚铁可作补铁剂 | ||
| C. | 浓硫酸可刻蚀石英制艺术品 | D. | 明矾用作净水剂 |
9.氧化铁是一种红色的颜料,在工业上常以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程如下:
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
若从硫酸亚铁溶液中结晶出FeSO4•7H2O,控制的温度(t)为t<56.7℃;
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
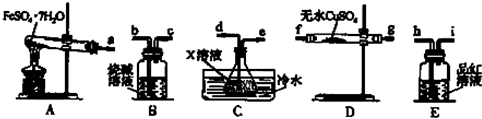
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.
请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
废液$→_{①}^{提纯、结晶}$FeSO4•7HO2$\stackrel{②}{→}$FeSO4溶液$→_{③}^{NH_{4}HCO_{3}溶液}$FeCO3$\stackrel{④}{→}$Fe2CO3
已知步骤①中硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示.
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
(1)步骤②需加一定量硫酸,其主要目的是抑制FeSO4的水解;
(2)生产FeCO3浊液的离子方程式为Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3浊液露置在空气中会出现红褐色的固体,该变化的化学方程式为4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)已知FeSO4•7H2O晶体在加热条件下发生反应,其中一种生成物会用于涂料中的着色剂.请写出
FeSO4•7H2O分解的反应式FeSO4•7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;利用如图装置可检验该反应的气体产物.

请填写下列空白:
①仪器的连接顺序为a 接f(或g)、g(或f)接d、e接h、i接b;
②装置C中的X为氯化钡溶液.
6.下列各组离子,可以形成无色透明碱性溶液的是( )
| A. | K+、NH4+、OH-、NO3- | B. | Mg2+、Na+、AlO2-、OH- | ||
| C. | Na+、Ba2+、OH-、SO42- | D. | Cu2+、Al3+、SO42-、Cl- |
7.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Cl-、NO3-、Fe3+ | |
| B. | 能使甲基橙显红色的溶液:CO32-、Na+、Cl-、SO42- | |
| C. | pH=1的溶液中:Mg2+、SO42-、Fe2+、Cu2+ | |
| D. | 能使铝钝化的溶液中:Ba2+、Na+、Cl-、I- |

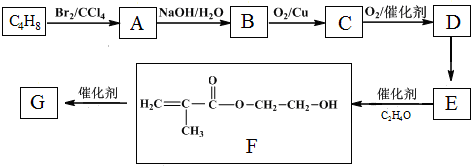
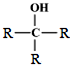 $\stackrel{O_{2}/Cu}{→}$不能被氧化
$\stackrel{O_{2}/Cu}{→}$不能被氧化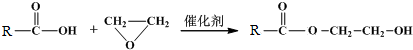
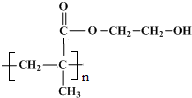 .
.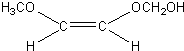 、
、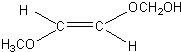 、
、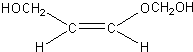 、
、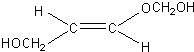 .
.