题目内容
14.下列有关的说法正确的是BC.A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高.
分析 A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
B.同周期随原子序数增大,元素的电负性增大;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高;
D.二氧化硫为V形结构;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高.
解答 解:A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S>Si,故A错误;
B.同周期随原子序数增大,元素的电负性增大,故电负性C<N<O<F,故B正确;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高,晶格能CaO比KCl高,所以KCl比CaO熔点低
,故C正确;
D.二氧化硫与二氧化碳均为酸性氧化物,化学性质相似,二氧化碳分子为直线型结构,但二氧化硫为V形结构,故D错误;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高,故E错误,
故选:BC.
点评 本题考查元素周期律、熔沸点高低比较,注意理解同周期元素第一电离能异常情况,掌握熔沸点高低比较规律.

练习册系列答案
相关题目
15.下列化学用语中,正确的是( )
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
16.硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g).
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
(2)反应2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡时的浓度比原来减小的是AC(填字母).
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
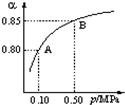
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
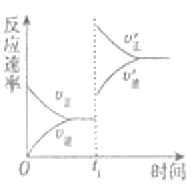
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
A.保持温度和容器体积不变,充入1mol O2(g)
B.保持温度和容器体积不变,充入2mol SO3 (g)
C.降低温度
D.在其他条件不变时,减小容器的容积.
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示,2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.平衡状态由A编导B时,平衡常数K(A)=K(B)(填“<”,“>”,或“=”),B点的化学平衡常数是800.
 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
②若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36 mol<n(SO3)<0.40mol.


 .
.

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)