题目内容
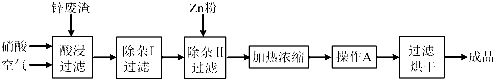
(14分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 ▲ 。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 ▲ 。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 ▲ 。为使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ▲ 。检验Fe3+是否沉淀完全的实验操作是 ▲ 。
⑷加入Zn粉的作用是 ▲ 。“操作A”的名称是 ▲ 。
⑴适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等)(写出一个措施得2分)
⑵烧杯、玻璃棒、漏斗 (2分,漏写一个得1分,漏写两个得0分)
⑶2Fe2++H2O2+2H+=2Fe3++2H2O (2分)
5.2~5.4 (2分,错一个得1分)
静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全(2分)
⑷除去溶液中的Cu2+ (2分)
冷却结晶 (2分)
解析:略

 轻松课堂单元期中期末专题冲刺100分系列答案
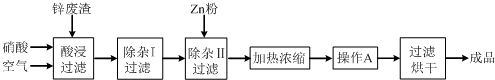
轻松课堂单元期中期末专题冲刺100分系列答案(14分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 ▲ 。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 ▲ 。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ▲ 。检验Fe3+是否沉淀完全的实验操作是 ▲ 。
⑷加入Zn粉的作用是 ▲ 。“操作A”的名称是 ▲ 。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
|
沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3 、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ 。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的 。