题目内容

| A.容器中的反应可表示为:3X(g)+Y(g)?2Z(g) |
| B.图1中,前3 min内X的反应速率为 v(X)=0.3mol/(L?min) |
| C.若其他条件不变,升高温度时反应的平衡常数K值变大 |
| D.若改变条件,反应进程如图3所示,则改变的条件是增大体系的压强 |
B、v=
| △n |
| V△t |
| (2.0-1.4)mol |
| 2L×3min |
C、由图2知,“先拐平数值大”,所以T2>T1,升高温度Y的含量减少,平衡向正反应方向移动,即生成物的浓度增大反应物的浓度减少,所以平衡常数增大,故C正确.
D、由图1和图3知,反应物和生成物的变化量不变,但反应时间减小,说明改变的条件不影响化学平衡只影响反应速率,且该反应是一个反应前后气体体积减小的反应,所以只能是使用催化剂,故D错误.
故选AC.

 阅读快车系列答案
阅读快车系列答案(12分)某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
| t/min | CO/mol | H2/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.10 |
| 3 | 0.75 | 0.50 | 0.25 |
| 5 | 0.65 | 0.30 | 0.35 |
| 7 | 0.55 | 0.10 | 0.45 |
| 9 | 0.55 | 0.10 | 0.45 |
| 10 | 0.55 | 0.10 | 0.45 |
(1)(根据上表中数据,在下图中画出CO、z的物质的量的浓度(c)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是 。
(3)在3—5 min时间内产物Z的平均反应速率: 。
(4)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(5)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有 (选填序号)。
a.升高温度 b.使用催化剂 C.再充人2 mol H2 d.再充人2 mol He
(12分)某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
|
t/min |
CO/mol |
H2/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.10 |
|
3 |
0.75 |
0.50 |
0.25 |
|
5 |
0.65 |
0.30 |
0.35 |
|
7 |
0.55 |
0.10 |
0.45 |
|
9 |
0.55 |
0.10 |
0.45 |
|
10 |
0.55 |
0.10 |
0.45 |
(1)(根据上表中数据,在下图中画出CO、z的物质的量的浓度(c)随时间(t)变化的曲线:

(2)体系中发生反应的化学方程式是 。
(3)在3—5 min时间内产物Z的平均反应速率: 。
(4)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(5)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有 (选填序号)。
a.升高温度 b.使用催化剂 C.再充人2 mol H2 d.再充人2 mol He
某温度时,在2L密闭容器中气态物质CO和H2反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
| t/min | CO/mol | H2/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.10 |
| 3 | 0.75 | 0.50 | 0.25 |
| 5 | 0.65 | 0.30 | 0.35 |
| 7 | 0.55 | 0.10 | 0.45 |
| 9 | 0.55 | 0.10 | 0.45 |
| 10 | 0.55 | 0.10 | 0.45 |
(1)(根据上表中数据,在下图中画出CO、z的物质的量的浓度(c)随时间(t)变化的曲线:

(2)体系中发生反应的化学方程式是 。
(3)在3—5 min时间内产物Z的平均反应速率: 。
(4)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(5)恒容条件下,下列措施中能使n(CH3OH)/n(CO)增大的有 (选填序号)。
a.升高温度 b.使用催化剂 C.再充人2 mol H2 d.再充人2 mol He
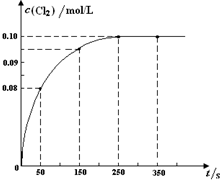 (2013?朝阳区二模)温度为T时,向2L恒容密闭容器中充入1mol PCl5,发生PCl5(g)?PCl3(g)+Cl2(g)反应.反应过程中c(Cl2) 随时间变化的曲线如图所示,下列说法不正确的是( )
(2013?朝阳区二模)温度为T时,向2L恒容密闭容器中充入1mol PCl5,发生PCl5(g)?PCl3(g)+Cl2(g)反应.反应过程中c(Cl2) 随时间变化的曲线如图所示,下列说法不正确的是( ) 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向2L密闭容器中充入4mol N2和6molO2,5min后达平衡时NO物质的量为4mol,该反应的速率v(N 2)为 ;计算该条件下的平衡常数(写出计算过程)。 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2
,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2
,在下图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。