题目内容
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,则水蒸气分解生成氢气和氧气的热化学议程式:
.若1g水蒸气转化成液态水放热2.444KJ,则反应2H2(g)+O2(g)=2H2O(l)的△H= KJ?mol-1.氢气的燃烧热为 KJ?mol-1.
(2)NH3(g)燃烧生成NO2(g)和H2O(g).已知:
①H2(g)+
O2(g)=H2O(g)△H1=-241.8kJ?mol-1
②
N2(g)+O2(g)=NO2(g)△H2=+33.9kJ?mol-1
③
N2(g)+
H2(g)=NH3(g)△H3=-46.0kJ?mol-1
试预测NH3(g)的燃烧热 .
.若1g水蒸气转化成液态水放热2.444KJ,则反应2H2(g)+O2(g)=2H2O(l)的△H=
(2)NH3(g)燃烧生成NO2(g)和H2O(g).已知:
①H2(g)+
| 1 |
| 2 |
②
| 1 |
| 2 |
③
| 1 |
| 2 |
| 3 |
| 2 |
试预测NH3(g)的燃烧热
考点:热化学方程式,用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,然后写出水蒸气分解生成氢气和氧气的热化学方程式;
根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;
氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol;
(2)依据热化学方程式和盖斯定律计算①×
+②-③可得到热化学方程式.
根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;
氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol;
(2)依据热化学方程式和盖斯定律计算①×
| 3 |
| 2 |
解答:
解:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/mol;则水蒸气分解生成氢气和氧气的热化学方程式为:H2O(g)=H2(g)+
O2(g)△H=+241.8kJ/mol,
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+
O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol,故氢气的燃烧热为285.8kJ/mol;
故答案为:H2O(g)=H2(g)+
O2(g)△H=+241.8kJ/mol;-285.5;285.5;
(2)已知:①H2(g)+
O2(g)=H2O(g)△H1=-241.8kJ?mol-1
②
N2(g)+O2(g)=NO2(g)△H2=+33.9kJ?mol-1
③
N2(g)+
H2(g)=NH3(g)△H3=-46.0kJ?mol-1
依据热化学方程式和盖斯定律计算①×
+②-③得到NH3(g)燃烧生成NO2 (g)和H2O(g) 热化学方程式:NH3(g)+
O2(g)=NO2(g)+
H2O(g)△H=-282.8kJ?mol-1 ,
故答案为:NH3(g)+
O2(g)=NO2(g)+
H2O(g)△H=-282.8kJ?mol-1.
| 1 |
| 2 |
| 1 |
| 2 |
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+
| 1 |
| 2 |
故答案为:H2O(g)=H2(g)+
| 1 |
| 2 |
(2)已知:①H2(g)+
| 1 |
| 2 |
②
| 1 |
| 2 |
③
| 1 |
| 2 |
| 3 |
| 2 |
依据热化学方程式和盖斯定律计算①×
| 3 |
| 2 |
| 7 |
| 4 |
| 3 |
| 2 |
故答案为:NH3(g)+
| 7 |
| 4 |
| 3 |
| 2 |
点评:考查热化学方程式的书写与反应热的计算、燃烧热等知识,题目难度不大,注意掌握热化学方程式的书写,燃烧热注意把握可燃物为1mol,生成稳定的氧化物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各有机化合物的命名正确的是( )
| A、CH2═CH-CH═CH2 1,3二丁烯 |
B、 3-丁醇 3-丁醇 |
C、 3,4,4-三甲基己烷 3,4,4-三甲基己烷 |
D、 2-甲基丁烷 2-甲基丁烷 |
下列各组物质中,属于同分异构体的是( )
| A、O2和O3 |
B、 和CH3CH=CHCH3 和CH3CH=CHCH3 |
C、 和CH2=CHCH3 和CH2=CHCH3 |
| D、CH3CH2OH和CH3OCH3 |
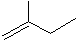 表示的分子式是
表示的分子式是