��Ŀ����
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g)  CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2
L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2
L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
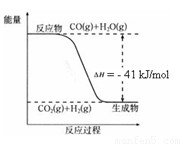
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10 min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
���𰸡�
��1������
��2��c(CO2)��c(H2)/ c(CO) ��c(H2O) ��
��3��0.0075 mol/(L��min)
���� 6.15
��4��CO(g)+ 1/2 O2(g) = CO2(g) ��H ����283 kJ/mol
����������

��ϰ��ϵ�д�
�����Ŀ
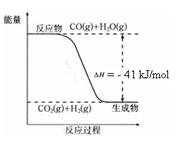
 CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��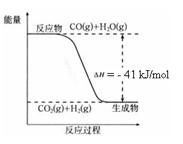
 CO2(g)+H2(g)����Ӧ�����������仯��ͼ��ʾ����500 ��ʱ��ƽ�ⳣ��K=9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0��1mol/L��10minʱ�ﵽƽ��״̬��
CO2(g)+H2(g)����Ӧ�����������仯��ͼ��ʾ����500 ��ʱ��ƽ�ⳣ��K=9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0��1mol/L��10minʱ�ﵽƽ��״̬�� 