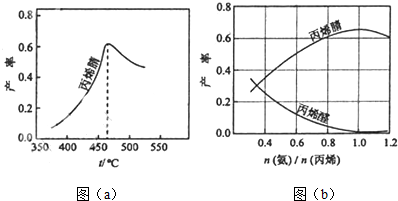
题目内容
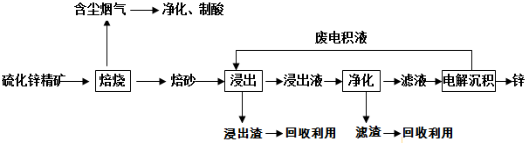
15.某工业废水中含有CN-和Cr2O7-等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程处理,回答下列问题: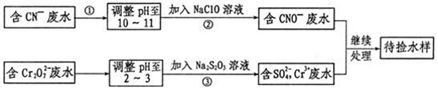
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为:CN-+ClO-═CNO-+Cl-.
(2)步骤③的反应为S2O32-+Cr2O72-+H+→SO42-+Cr3++H2O(未配平),则每消耗0.4molCr2O72-转移2.4mol e-.
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去;
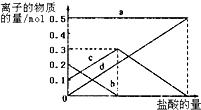
(4)在25℃下,将amol•L-1的NaCN溶液与0.01mol•L-1的盐酸等体积混合,反应后测得溶液pH=7,则a>0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=(100a-1)×10-7 mol•L-1.
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,该过程中反应的离子方程式是:Cu2++2OH-═Cu(OH)2↓,Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
分析 流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样,
(1)步骤②中,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+即可计算出转移电子的物质的量;
(3)加入熟石灰进一步处理,调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)反应后测得溶液pH=7,则可推知NaCN过量,根据电荷守恒和物料守恒即可计算出CN-和HCN的浓度,进而计算出Ka﹦(100a-1)×10-7 mol•L-1;
(5)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
解答 解:(1)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,离子反应为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(2)根据0.4 mol Cr2O72-等转化为Cr3+,铬元素化合价降低3价,0.4molCr2O72-共得到了0.4×(2×3)mol=2.4mol;
故答案为:2.4;
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是调节废水pH,使其转化成Cr(OH)3沉淀除去;
故答案为:调节废水pH,使其转化成Cr(OH)3沉淀除去;
(4)由于反应后测得溶液pH=7,当a=0.01时,恰好反应,生成了氰化氢溶液,溶液显示酸性,则氰化钠应该多些,故a>0.01;
由电荷守恒c(Na+)+c(H+)=c(OH-)+c(CN-)+c(Cl-)及pH=7,可知c(H+)=c(OH-)=10-7 mol•L-1,c(CN-)=c(Na+)-c(Cl-)=$\frac{a}{2}$mol/L-$\frac{0.01}{2}$mol/L,再根据物料守恒:c(CN-)+c(HCN)=c(Na+)=$\frac{a}{2}$mol/L;Ka﹦$\frac{c(H{\;}^{+})c(CN{\;}^{-})}{c(HCN)}$=$\frac{1{0}^{-7}×(\frac{a}{2}-\frac{0.01}{2})}{\frac{0.01}{2}}$=(100a-1)×10-7 mol•L-1;
故答案为:>;(100a-1)×10-7 mol•L-1;
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,涉及的离子反应方程式为Cu2++2OH-═Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),
故答案为:Cu2++2OH-═Cu(OH)2↓;Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
点评 本题以工艺流程为载体,侧重化学基本概念、基本理论,考查了氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识.考查学生的知识运用能力、灵活分析处理实际问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
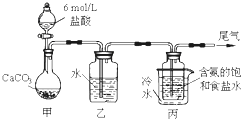
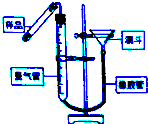 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.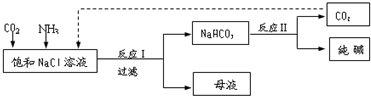
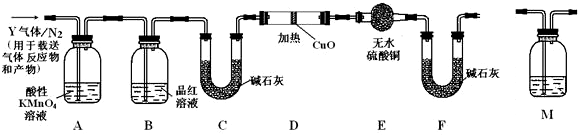
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.