题目内容
为提纯含NaCl和Na2SO4两种杂质的NaNO3溶液,且逐一分离出杂质,某同学设计了如下的实验流程:

(1)操作①②③的名称都是 (填操作名称).
(2)写出试剂的名称:试剂1 ;试剂2 .
(3)操作③之前加入Na2CO3的目的是 .
(4)加入试剂4后,发生反应的离子方程式为 .控制试剂4的加入量“适量”的方法是 .

(1)操作①②③的名称都是
(2)写出试剂的名称:试剂1
(3)操作③之前加入Na2CO3的目的是
(4)加入试剂4后,发生反应的离子方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:化学实验基本操作
分析:如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3.
解答:
解:分离溶液中的Cl-,应加入AgNO3,分离溶液中的SO42-,应加入BaCl2[或Ba(NO3)2],如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,所以试剂1为BaCl2[或Ba(NO3)2],试剂2为AgNO3,试剂3为Na2CO3,试剂4为HNO3,
(1)由以上分析知操作①②③的名称都是过滤,故答案为:过滤;
(2)由以上分析知试剂1为BaCl2[或Ba(NO3)2],试剂2为AgNO3,故答案为:BaCl2[或Ba(NO3)2];AgNO3;
(3)加入过量的BaCl2[或Ba(NO3)2],在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应后溶液中存在过量的Ag+、Ba2+,在操作②所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,故答案为:除去溶液中过量的Ag+、Ba2+;
(4)加入硝酸后,反应离子方程式为CO32-+2H+=CO2↑+H2O,由于是产生二氧化碳气体,可以通过观察气泡的产生判断加入硝酸的量,故答案为:CO32-+2H+=CO2↑+H2O;如果不再冒气泡,则停止加入硝酸.
(1)由以上分析知操作①②③的名称都是过滤,故答案为:过滤;
(2)由以上分析知试剂1为BaCl2[或Ba(NO3)2],试剂2为AgNO3,故答案为:BaCl2[或Ba(NO3)2];AgNO3;
(3)加入过量的BaCl2[或Ba(NO3)2],在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,反应后溶液中存在过量的Ag+、Ba2+,在操作②所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,故答案为:除去溶液中过量的Ag+、Ba2+;
(4)加入硝酸后,反应离子方程式为CO32-+2H+=CO2↑+H2O,由于是产生二氧化碳气体,可以通过观察气泡的产生判断加入硝酸的量,故答案为:CO32-+2H+=CO2↑+H2O;如果不再冒气泡,则停止加入硝酸.
点评:本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

练习册系列答案
相关题目
有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化学工业的发展水平.A、B、C、D、E有下图所示的关系.则下列推断不正确的是( )
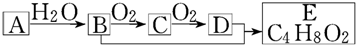
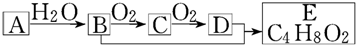
| A、A→B属于加成反应 | |||
| B、B、D均能与金属钠反应 | |||
| C、物质C的结构简式为CH3CHO | |||
D、生成E的化学方程式为:CH3CH2OH+CH3COOH
|
下列应用或事实没有体现出胶体的性质的是( )
| A、用明矾净化饮用水 |
| B、清晨林间透过缕缕阳光 |
| C、三氯化铁溶液中加入NaOH出现红褐色沉淀 |
| D、向煮熟的豆浆中加入石膏或卤水以生产豆腐 |
下列表述正确的是( )
| A、醛基的结构简式-COH |
B、聚丙烯的结构简式 |
C、羟基的电子式 |
D、3-甲基-1-丁烯的键线式 |
下列各组物质中,前者是单质,中间是氧化物,后者是混合物的是( )
| A、氯气、次氯酸钠、氯水 |
| B、水银、氧化镁、碘化银胶体 |
| C、木炭、二氧化硫、冰和水 |
| D、钠、氧化钙、过氧化钠 |
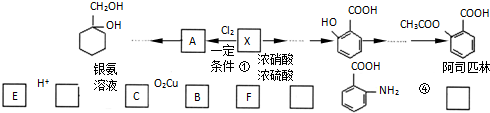

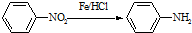 (苯胺,易被氧化)
(苯胺,易被氧化)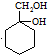 的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH
的合成路线流程图(无机试剂任用).合成路线流程图示例如:CH3CH2OH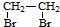
 (1)有机物X 的质谱图为:
(1)有机物X 的质谱图为: