题目内容
向两支分别盛有0.1 mol/L醋酸和饱和硼酸(H3BO3)溶液的试管中滴加等浓度碳酸钠溶液,实验现象为(1)________,三种酸由强到弱的顺序是(用化学式表示)(2)________,硼酸(H3BO3)在食品、医药领域应用广泛.
(3)请完成B2H6气体与水反应的化学方程式:B2H6+6H2O=2H3BO3+________.
(4)在其他条件相同时,反应H3BO3+3CH3OH B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化见下图,由此图可得出:

①温度对应该反应的反应速率和平衡移动的影响是________.
②该反应的ΔH________0(填“<”、“=”或“>”).
(5)H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)
[B(OH)4]-(aq)+H+(aq)
已知0.70 mol·L-1 H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5 mol·L-1,c平衡(H3BO3)≈c起始(H3BO 3),水的电离可忽略不计,此温度下该反应的平衡常数K=________,(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:
(1)醋酸能碳酸钠溶液反应放出二氧化碳气体,而硼酸不能
(2)CH3COOH>H2CO3>H3BO3
(3)B2H6+6H2O 2H3BO3+6H2.
2H3BO3+6H2.
(4)①
温度升高,H3BO3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应②ΔH>0
(5)K=![]() =
=![]() =
=![]()

| |||||||||||||||
 B(OCH3)3 +3H2O中,H3BO3的转化率(
B(OCH3)3 +3H2O中,H3BO3的转化率( )在不同温度下随反应时间(t)的变化见下图,由此图可得出:
)在不同温度下随反应时间(t)的变化见下图,由此图可得出:
 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).

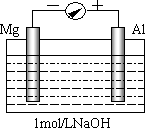
 ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
