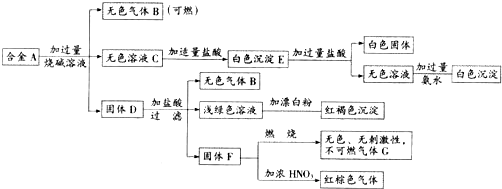
题目内容
为了探究HClO的漂白性,某同学设计了如图所示的实验:
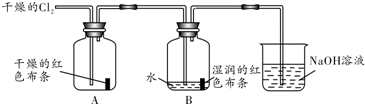
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 .
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是 ,其中发生反应的化学方程式是 .
(3)为了确证是HClO起漂白作用,你认为还应增加的实验是 .
(4)烧杯中发生反应的化学方程式是 .

(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
(2)从集气瓶B中湿润的红色布条的现象可得出的结论是
(3)为了确证是HClO起漂白作用,你认为还应增加的实验是
(4)烧杯中发生反应的化学方程式是
考点:氯、溴、碘的性质实验
专题:实验题
分析:(1)干燥的氯气进入A中,干燥的红色布条不褪色;
(2)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(3)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(4)最后利用NaOH溶液吸收氯气,进行尾气处理.
(2)氯气能使湿润的有色布条褪色,但是不能使干燥的有色布条褪色,次氯酸具有漂白性,氯气没有漂白性;
(3)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(4)最后利用NaOH溶液吸收氯气,进行尾气处理.
解答:
解:(1)通入Cl2后,从集气瓶A中观察到干燥的红色布条不褪色,可得出的结论干燥的氯气没有漂白性,故答案为:干燥的氯气没有漂白性;
(2)从集气瓶B中湿润的红色布条褪色,可得出的结论是HClO能漂白,因为氯气和水反应Cl2+H2O?HCl+HClO,生成的次氯酸具有漂白性,
故答案为:氯水具有漂白性;Cl2+H2O?HCl+HClO;
(3)由Cl2+H2O?HCl+HClO可知,生成盐酸和HClO,则设计一个实验为验证HCl是否有漂白性,操作方法是在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,故答案为:验证HCl是否有漂白性;
(4)氯气有毒,不能排放在空气中,NaOH溶液所起的作用是吸收多余的氯气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O.
(2)从集气瓶B中湿润的红色布条褪色,可得出的结论是HClO能漂白,因为氯气和水反应Cl2+H2O?HCl+HClO,生成的次氯酸具有漂白性,
故答案为:氯水具有漂白性;Cl2+H2O?HCl+HClO;
(3)由Cl2+H2O?HCl+HClO可知,生成盐酸和HClO,则设计一个实验为验证HCl是否有漂白性,操作方法是在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,故答案为:验证HCl是否有漂白性;
(4)氯气有毒,不能排放在空气中,NaOH溶液所起的作用是吸收多余的氯气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O,故答案为:2NaOH+Cl2═NaCl+NaClO+H2O.
点评:本题考查性质实验方案的设计,为高频考点,把握实验装置的作用、发生的反应、实验设计的分析为解答的关键,注意验证HClO具有漂白性,利用对比和排除干扰的方法来解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、可用碘水鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、取0.2mol NaCl固体于烧杯中,加入200 mL蒸馏水充分搅拌可配成1mol/L的NaCl溶液 |
| C、测定溶液的酸碱性时,应先将pH试纸润湿,然后进行检测 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
下列能大量共存且溶液为无色透明的离子组是( )
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
下列叙述正确的是( )
| A、甲苯、苯乙烯都能使酸性高锰酸钾溶液褪色,也都能与溴的四氯化碳溶液反应而褪色 |
| B、天然气和液化石油气的主要成分都是烃 |
| C、溴乙烷和乙醇在相同的反应条件下都可以生成乙烯 |
| D、石蜡是从石油中获取的油脂 |
将1.5克某物质在氧气中完全燃烧,产物为4.4g二氧化碳和2.7g水,根据此实验事实,不能得出的实验结果是( )
| A、一定含有碳、氢两种元素 |
| B、一定含有氧元素 |
| C、该物质为有机化合物 |
| D、氢元素的质量分数为20% |
下列叙述正确的是( )
| A、当温度升高时,弱酸的电离平衡常数Ka变小 |
| B、某温度下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L |
| C、由Ksp(AgCl)>Ksp(AgI)可判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能发生 |
| D、常温下,pH=12氨水与pH=2盐酸等体积混合c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
下列说法正确的是( )
| A、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| B、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| C、除掉CH4中的C2H4可用溴的CCl4溶液 |
| D、分子式为C10H14的单取代芳烃,其可能的结构有5种 |