题目内容
(1)选择题
①根据下列热化学方程式
(1)C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
(2)H2(g)+![]() O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol[Ks5u.com]
(3)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=-488.3 kJ/mol B.ΔH=+244.1 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
 ②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
②右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中、d电极质量增加
D.电解过程中,氯离子浓度不变
③如下图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )
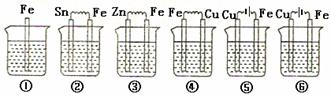
A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
(2)通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中断裂的化学键的键能之和与反应中形成新的化学键的键能之和的差
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/KJ.mol | 360 | 436 | 431 | 176 |
工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)==Si(s)+4HCl(g),该反应的反应热△H为多少?
(1)①A ②C ③C
(2)+236

《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
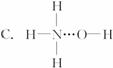
 的沸点高于
的沸点高于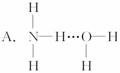


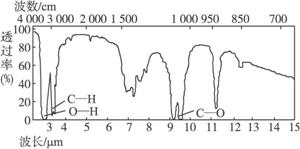
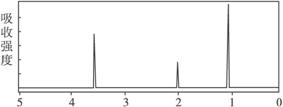
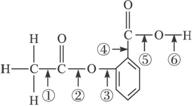
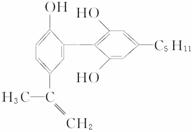


 4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。
4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。 分子中所有原子不可能共平面
分子中所有原子不可能共平面
