题目内容
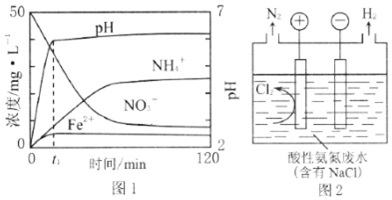
3.含氮废水需经处理后排放,有的含氮废水中含有NO3-,有的含氮废水中含有NH4+,不同的含氮废水处理方法不同.(1)某实验小组利用Fe粉和KNO3溶液反应,模拟含氮废水脱氮过程,探究脱氮原理.
实验前:先用0.1mol/L H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质.然后用蒸馏水洗涤至中性,将KNO3溶液的pH调至2.5,为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入N2(写化学式).
(2)有氧气时,在硝化细菌作用下,NH4+可发生如下转化,请将离子方程式补充完整:
4NH4++5O2═N2O+6H++2NO2-+5H2O.
(3)图2是间接氧化工业废水中氨氮(NH4+)的示意图.
①阳极区溶液中发生反应的离子方程式为:3Cl2+2NH4+=N2+8H++6Cl-;
②当生成H2和N2的物质的量之比为3:1时,测得处理后废水的pH减小,请简述原因:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
分析 (1)铁表面有铁锈加入硫酸可除去,除去溶液中的氧气,可向溶液中通入氮气;
(2)依据元素化合价变化,计算电子转移,结合电子守恒、电荷守恒、原子守恒配平书写离子方程式;
(3)①装置图分析可知和电源正极相连的为阳极,溶液中氯离子在阳极失电子生成氯气,氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去;
②结合电解池中的电极反应和生成H2和N2的物质的量之比为3:1,依据电极反应中电子守恒计算溶液中氢离子浓度减小和氢离子浓度增加,判断溶液PH变化.
解答 解:(1)H2SO4可以除去Fe粉表面的氧化物;为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2.
故答案为:去除铁粉表面的氧化物等杂质; N2;
(2)铵根中氮元素化合价-3价变化为+1价,和+3价,被氧化得到电子转移总数为(8+12)e-=20e-,生成2molNO2-,氧元素化合价0价变化为-2价,被还原电子转移总数4e-,原子守恒缺项为水,电子守恒和原子守恒得到:4NH4++5O2=N2O+6H++2NO2-+5H2O
故答案为:6;2;5H2O;
(3)①装置图分析可知和电源正极相连的为阳极,溶液中氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2 ↑,氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去,反应的离子方程式为:3Cl2+2NH4+=N2+8H++6Cl-,
故答案为:3Cl2+2NH4+=N2+8H++6Cl-;
②电解池中阳极电极反应是:2Cl--2e-=Cl2↑,3Cl2+2NH4+=N2+8H++6Cl-,阴极电极反应为:2H++2e-=H2↑,若生成n (H2):n (N2)=3:1,电子守恒得到6H+~3H2~6e-~N2~3Cl2~6e-~8H+,阳极产生的H+比阴极消耗的H+多,则 PH减小,
故答案为:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多.
点评 本题考查元素化合物的性质、除杂以及氧化还原反应离子方程式配平、电解原理分析等问题,综合性较强,注意原理的理解应用,题目难度中等.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 二氧化硅熔点高,可用作光导纤维 | |
| B. | 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂 | |
| C. | 明矾易溶于水,可用作净水剂 | |
| D. | 二氧化硫有氧化性,可用于漂白纸张 |
 纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而倍受关注,表为制取纳米级Cu2O的三种方法:| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$ Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-ckJ•mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=-(a+b-2c)kJ•mol-1.
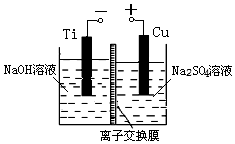
(3)方法Ⅱ通过采用离子交换膜控制电解液中OH-浓度的方法来制备纳米级Cu2O,电解装置如图所示.
①阴极上的还原产物是H2.
②已知阳极生成Cu2O,电极反应式为2Cu-2e-+2OH-=Cu2O+H2O.
③Na2SO4溶液的主要作用是增强溶液的导电性.
(4)方法Ⅲ是在加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该反应的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(5)肼又称联氨,请写出肼的电子式
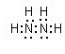 ,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.
,肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因N2H4+H2O?N2H5++OH-.(6)已知在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度.常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(7)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是N2H4+4OH--4e-=4H2O+N2↑,电池工作一段时间后,电解质溶液的pH将减小(填“增大”、“减小”、“不变”).
| A. | 7.1g37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78g | |
| C. | 7.8g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24L乙烷含有的共价键数为1.9NA |
| A. | 含有大量Ba2+ 的溶液:Na+、SO42-、NH4+ | |
| B. | 0.1mol/LNa2CO3溶液:K+、AlO2-、Cl-、NO3- | |
| C. | 25°C时pH<7的溶液:K+、Cu2+、Fe3+、NO3- | |
| D. | 遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
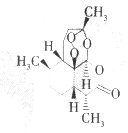 中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )
中国中医研究院终身研究员兼首席研究员屠呦呦于1971年首先从黄花蒿中发现抗疟有效提取物,1972年分离出新型结构的抗疟有效成分青蒿素,拯救了数千万人的生命.青蒿素的分子结构如图.下列说怯错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿素是芳香族化合物 | |
| C. | 青蒿素分子中含有过氧链、酯基和醚键 | |
| D. | 青蒿素不能发生加成反应 |
| 容器编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| N2 | H2 | NH3 | NH3 | ||
| ① | 500 | 1 | 3 | 0 | 0.5 |
| ② | 500 | 0.6 | 1.8 | 0 | |
| ③ | 550 | 0 | 0 | 2 | a |
| A. | 容器①、②中反应的平衡常数不相等 | |
| B. | 达平衡时,容器②中H2的转化率大于25% | |
| C. | a<0.5 | |
| D. | 起始时向容器①中充入1 mol N2、2 mol H2、0.5 mol NH3,则反应将向逆反应方向进行 |
| A. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) | |
| B. | 简单氢化物的稳定性:W>Z | |
| C. | 元素X的单质只存在两种同素异形体 | |
| D. | X、Y、W最高价氧化物对应的水化物两两之间能发生反应 |