题目内容
10.物质的量相同的下列有机物完全燃烧,耗氧量最多的是( )| A. | C2H6 | B. | C4H6 | C. | C5H10 | D. | C6H12O2 |
分析 等物质的量均设为1mol,有机物CxHyOz完全燃烧耗氧量取决于(x+$\frac{y}{4}$-$\frac{z}{2}$),(x+$\frac{y}{4}$-$\frac{z}{2}$)值越大耗氧量越大,以此来解答.
解答 解:设均为1mol,则
A.消耗氧气为1mol×(2+$\frac{6}{4}$)=3.5mol;
B.消耗氧气为1mol×(4+$\frac{6}{4}$)=5.5mol;
C.消耗氧气为1mol×(5+$\frac{10}{4}$)=7.5mol;
D.消耗氧气为1mol×(6+$\frac{12}{4}$-$\frac{2}{2}$)=8mol,
故选D.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握燃烧规律及消耗氧气的计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
1.氢气是化工行业重要原料之一.
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解200mL饱和食盐水一段时间后,溶液质量减轻0.73g(假设气体全部逸出).生产氢气在标准状况下的体积为224mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷此过程生成0.24m3氢气,则甲烷的裂解率为16%(体积均在相同条件下测定).
(3)已知:CxH7+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如表所示.
计算原混合气体中甲烷与乙烷的物质的量之比.
(4)合成氨生产过程中,消耗氮氢混合气2800m3(其中CH4的体积分数为0.2%,下同),分离液氨后的氮氢混合气中含CH43%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
(1)电解饱和食盐水是生产H2的方法之一.常温下,电解200mL饱和食盐水一段时间后,溶液质量减轻0.73g(假设气体全部逸出).生产氢气在标准状况下的体积为224mL.
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1m3甲烷此过程生成0.24m3氢气,则甲烷的裂解率为16%(体积均在相同条件下测定).
(3)已知:CxH7+H2O→CO+CO2+H2(未配平).工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如表所示.
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
(4)合成氨生产过程中,消耗氮氢混合气2800m3(其中CH4的体积分数为0.2%,下同),分离液氨后的氮氢混合气中含CH43%.计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况).
18.最近报道了一种新型可逆电池,该电池的负极为金属铝,正极为石墨化合物Cn[AlCl4],电解质为R+(烃基取代咪唑阳离子)和[AlCl4]-阴离子组成的离子液体.电池放电时,在负极附近形成双核配合物[Al2Cl7]-.充放电过程中离子液体中的阳离子始终不变.下列说法中错误的是( )
| A. | 放电时,正极反应式为Cn[AlCl4]+e-═[AlCl4]-+Cn | |
| B. | 充电时,阴极反应式为4[Al2Cl7]-3e-═Al+7[AlCl4]- | |
| C. | 放电过程中,负极每消耗1mol Al,导线中转移的电子数为3NA(NA为阿伏伽德罗常数的值) | |
| D. | 充、放电过程中,R+的移动方向相反 |
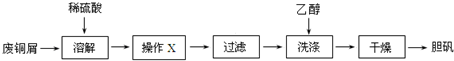
8.铁触媒(铁的某氧化物)是工业合成氨的催化剂.某同学设计了以下两种方案研究铁触媒的组成.
方案一:用下列流程测定铁触媒的含铁量,确定其组成.

(1)步骤④后面需用酸式滴定管(填仪器名称)取25.00mL稀释后溶液.
(2)因为通入Cl2不足量,“溶液B”中还含有FeCl2 或者FeSO4或者Fe2+会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液.
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成.

(4)“干燥管C”的作用是防止空气中的CO2和水蒸气进入B中.
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为Fe4O5或2FeO•Fe2O3.(相对原子质量:C-12 O-16 Fe-56)
方案一:用下列流程测定铁触媒的含铁量,确定其组成.

(1)步骤④后面需用酸式滴定管(填仪器名称)取25.00mL稀释后溶液.
(2)因为通入Cl2不足量,“溶液B”中还含有FeCl2 或者FeSO4或者Fe2+会影响测定结果.
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2.请设计实验方案检验Cl2,完成下列实验报告.限选试剂:0.1mol•L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL•L-1KSCN溶液.
| 实验操作 | 实验现象与结论 |

(4)“干燥管C”的作用是防止空气中的CO2和水蒸气进入B中.
(5)称取15.2g铁触媒进行上述实验.充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为Fe4O5或2FeO•Fe2O3.(相对原子质量:C-12 O-16 Fe-56)
5.当光束通过下列分散系时,能形成一条光亮通路的是( )
| A. | 食盐水 | B. | 碘酒 | C. | 淀粉溶液 | D. | Fe(OH)3沉淀 |
6.已知:A~F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:
(1)A、B、C的电负性由小到大的顺序为C<O<N(用元素符号表示).
(2)D元素的原子核外共有12种不同运动状态的电子、4种不同能级的电子.
(3)写出E的基态原子的电子排布式:1s22s22p63s23p64s2.
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态.
(1)A、B、C的电负性由小到大的顺序为C<O<N(用元素符号表示).
(2)D元素的原子核外共有12种不同运动状态的电子、4种不同能级的电子.
(3)写出E的基态原子的电子排布式:1s22s22p63s23p64s2.
(4)F和X(质子数为25)两元素的部分电离能数据列于下表:比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+的3d轨道电子数为6,不是较稳定状态.
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |