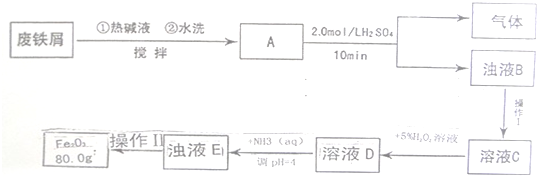
题目内容
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如图:
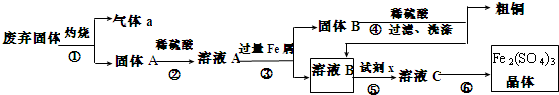
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为 ;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致,现给出以下试剂:1.0mol?L-1硫酸、1.0mol?L-1 NaOH溶液、0.1mol?L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证乙同学的猜测是否合理.简要说明实验步骤和现象 .

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为
(2)试剂x的化学式为
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致,现给出以下试剂:1.0mol?L-1硫酸、1.0mol?L-1 NaOH溶液、0.1mol?L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水.请你设计合理实验验证乙同学的猜测是否合理.简要说明实验步骤和现象
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废弃固体煅烧Cu2S与氧气反应生成氧化铜,则固体A为氧化铜和氧化铁的混合物,稀硫酸溶解生成二价铜和三价铁离子,再加过量的铁将三价铁还原成二价铁,二价铜还原成铜单质,过滤得固体B为铜和铁的混合物,溶液B则为二价铁溶液,加入试剂x氧化亚铁离子得溶液C含三价铁离子,进一步提纯得到硫酸铁晶体,以此分析;
(1)①固体灼烧用到容器坩埚和夹持仪器坩埚钳;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体中都用到的玻璃棒;
(2 )加入试剂x氧化亚铁离子,使用试剂不能引进新的杂质,所以选用双氧水做氧化剂,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(3)通过重新滴加硫氰化钾溶液,证明该同学的假设是否合理.
(1)①固体灼烧用到容器坩埚和夹持仪器坩埚钳;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体中都用到的玻璃棒;
(2 )加入试剂x氧化亚铁离子,使用试剂不能引进新的杂质,所以选用双氧水做氧化剂,反应方程式:H2O2 2Fe2++H2O2 +2H+=2Fe3++2H2O;
(3)通过重新滴加硫氰化钾溶液,证明该同学的假设是否合理.
解答:
解:废弃固体煅烧Cu2S与氧气反应生成氧化铜,则固体A为氧化铜和氧化铁的混合物,稀硫酸溶解生成二价铜和三价铁离子,再加过量的铁将三价铁还原成二价铁,二价铜还原成铜单质,过滤得固体B为铜和铁的混合物,溶液B则为二价铁溶液,加入试剂x氧化亚铁离子得溶液C含三价铁离子,进一步提纯得到硫酸铁晶体;
(1)①灼烧固体应该放在坩埚中,坩埚用坩埚钳夹持;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体都用到玻璃棒,
故答案为:坩埚,坩埚钳; 玻璃棒;
(2)由于加入试剂x目的是氧化亚铁离子,使用试剂不能引进新的杂质,所以选用双氧水做氧化剂,反应方程式:2Fe2++H2O2 +2H+=2Fe3++2H2O,
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(3)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,
故答案为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol?L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理).
(1)①灼烧固体应该放在坩埚中,坩埚用坩埚钳夹持;①灼烧操作和⑥溶液浓缩析出硫酸铁晶体都用到玻璃棒,
故答案为:坩埚,坩埚钳; 玻璃棒;
(2)由于加入试剂x目的是氧化亚铁离子,使用试剂不能引进新的杂质,所以选用双氧水做氧化剂,反应方程式:2Fe2++H2O2 +2H+=2Fe3++2H2O,
故答案为:H2O2;2Fe2++H2O2 +2H+=2Fe3++2H2O;
(3)重新加入硫氰化钾溶液,若是溶液变红,说明该同学猜测合理,否则不合理,方法为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理,
故答案为:取少量褪色后的溶液于试管中,逐滴加入过量的20%KSCN溶液,如溶液变红色,说明乙同学的猜测是合理的,如不变红色,说明猜测不合理(或滴加过量的0.1 mol?L-1 Fe2(SO4)3溶液,如溶液不变红色,说明合理,若变红色,说明猜测不合理).
点评:本题借助氯化铁固体的制取,考查了实验操作中仪器名称、试剂选择、硫酸铁溶液配制、检验方案的试剂、离子方程式书写等知识,题目综合性较强,充分考查了学生的分析、理解能力,本题难度中等.

练习册系列答案
相关题目
20g密度为dg/cm3的硝酸钙溶液中,含有1gCa2+离子,则NO3-离子的物质的量浓度为( )
A、
| ||
B、
| ||
| C、2.5dmol/L | ||
| D、1.25dmol/L |
下列说法正确的是(NA表示阿伏加德罗常数)( )
| A、在常温常压下,11.2LN2含有的分子数为0.5NA |
| B、在常温常压下,1molHe含有的原子数为NA |
| C、1mol H2O中含有2mol氢和1mol氧 |
| D、23g钠在化学反应中失去电子数目为10 NA |
将2.3g Na放入100mL浓度为0.1mol?L-1的盐酸中,充分反应后共生成标准状况下H2的体积为( )
| A、0.112L |
| B、1.12L |
| C、0.224L |
| D、2.24L |
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列说法正确的是( )
| A、M与X形成的化合物对应的水化物一定是强酸 |
| B、Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 |
| C、X、Y的简单离子半径:r(X2-)>r(Y+) |
| D、M的气态氢化物比N的气态氢化物稳定 |
下列物质的体积最大的是( )
| A、标况下,0.3 mol的NH3 |
| B、4℃时,18克水 |
| C、2mol的Al (密度为2.7g/cm3 ) |
| D、100g 37% 密度1.20 g/cm3 NaCl 溶液 |