��Ŀ����
����Ŀ����֪�Ȼ��������۵�674�桢�е�1023�棻���Ȼ�����300��������������������ˮ������ǿ�ҵ���ˮ�ԣ���500���������Ȼ��������������ܷ������ַ�Ӧ����Ӧ֮һΪ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺
2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺ 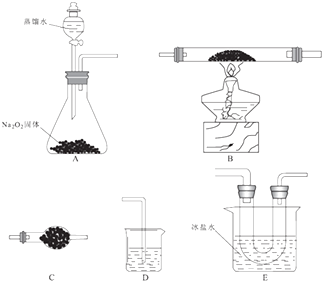
��1��װ�õĺ�������˳��ΪA����D������Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���� ��
��2��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ���̷��֣�װ��B�г����ɺ���ɫ�����⣬���۲쵽����ɫ���壬���ɸ�����Ļ�ѧ����ʽΪ ��
��4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������ ��
��5�����ʵ�飺 ������Eװ��U�ι���Ĺ�����֤Fe��OH��3����� ��
�ڲⶨװ��B�IJ�����������Ԫ�ص����������� ��
���𰸡�
��1��CBEC����ֹFeCl3�����ڵ����У���������
��2��2Na2O2+2H2O=4NaOH+O2��
��3��4FeCl2+3O2 ![]() 2Fe2O3+4Cl2
2Fe2O3+4Cl2
��4��Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ
��5��ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤����ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2�������ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س���
���������⣺��1���Ȼ�������ȡ�Ȼ���������ʵ�飺��Ӧԭ��Ϊ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ������ȡ������װ��A��2Na2O2+2H2O=4NaOH+O2������ȡ�������к���ˮ�����������Ȼ���������ˮ������ǿ�ҵ���ˮ�ԣ����ȥ�����е�ˮ������ѡ��װ��C����500���������Ȼ��������������ܷ������ַ�Ӧ��װ��B�У�12FeCl2+3O2
2Fe2O3+8FeCl3 �� ������ȡ������װ��A��2Na2O2+2H2O=4NaOH+O2������ȡ�������к���ˮ�����������Ȼ���������ˮ������ǿ�ҵ���ˮ�ԣ����ȥ�����е�ˮ������ѡ��װ��C����500���������Ȼ��������������ܷ������ַ�Ӧ��װ��B�У�12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ͬʱ��������Ӧ4FeCl2+3O2
2Fe2O3+8FeCl3 �� ͬʱ��������Ӧ4FeCl2+3O2 ![]() 2Fe2O3+4Cl2 �� ��B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ�����Ȼ�����300������������������װ��EŨ��ˮ��ȴ�Ȼ�����Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���Ƿ�ֹFeCl3�����ڵ����У��������ܣ������װ��Dʢ�ż�����Һ����β���� ���Դ��ǣ�CBEC����ֹFeCl3�����ڵ����У��������ܣ���2��װ��A�й������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
2Fe2O3+4Cl2 �� ��B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ�����Ȼ�����300������������������װ��EŨ��ˮ��ȴ�Ȼ�����Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���Ƿ�ֹFeCl3�����ڵ����У��������ܣ������װ��Dʢ�ż�����Һ����β���� ���Դ��ǣ�CBEC����ֹFeCl3�����ڵ����У��������ܣ���2��װ��A�й������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
���Դ��ǣ�2Na2O2+2H2O=4NaOH+O2������3��װ��B�����ɺ���ɫ����Ϊ���������۲쵽����ɫ����Ϊ�������Ȼ�������������Ӧ��������������������Ӧ����ʽΪ��4FeCl2+3O2 ![]() 2Fe2O3+4Cl2 ��
2Fe2O3+4Cl2 ��
���Դ��ǣ�4FeCl2+3O2 ![]() 2Fe2O3+4Cl2����4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ��������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����֤װ��B�У�12FeCl2+3O2
2Fe2O3+4Cl2����4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ��������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����֤װ��B�У�12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ��Ӧ��ȫ��
2Fe2O3+8FeCl3 �� ��Ӧ��ȫ��
���Դ��ǣ�Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����5������֤Fe��OH��3�������ͨ���Ȼ���Ϊǿ��������ˮ������Խ��м��飬ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤��
���Դ��ǣ�ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤��
�ڲⶨװ��B�IJ�����������Ԫ�ص�������������ͨ���ⶨ������ʵ�飬����Ϊ����ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2�������ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س�����
���Դ��ǣ���ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2��������Ҳ�ɣ��ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س�����

 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�

