题目内容
a g铁粉与含有H2SO4的硫酸铜溶液完全反应后得到a g Cu,则参加反应的硫酸铜与硫酸的物质的量之比为 .
考点:铁的化学性质,化学方程式的有关计算
专题:几种重要的金属及其化合物
分析:发生反应:Fe+CuSO4═FeSO4+Cu,Fe+H2SO4═FeSO4+H2↑,得到Cu的质量与Fe的质量相等,说明Fe与硫酸铜反应中固体增重等于与硫酸反应的Fe的质量,令与硫酸反应的Fe的质量为56g,根据方程式计算参加反应的硫酸铜、硫酸的物质的量,以此来解答.
解答:
解:得到Cu的质量与Fe的质量相等,说明Fe与硫酸铜反应中固体增重等于与硫酸反应的Fe的质量,
设与硫酸反应的Fe的质量为56g,则:
Fe+CuSO4═FeSO4+Cu 固体增重
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)=
=7mol,
Fe+H2SO4═FeSO4+H2↑
56g 1mol
故参加反应的硫酸铜与硫酸的物质的量之比为7mol:1mol=7:1,
故答案为:7:1.
设与硫酸反应的Fe的质量为56g,则:
Fe+CuSO4═FeSO4+Cu 固体增重
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)=
| 1mol×56g |
| 8g |
Fe+H2SO4═FeSO4+H2↑
56g 1mol
故参加反应的硫酸铜与硫酸的物质的量之比为7mol:1mol=7:1,
故答案为:7:1.
点评:本题考查铁的化学性质及计算,为高频考点,把握发生的反应及反应前后固体质量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
关于如图进行的实验的说法,正确的是( )
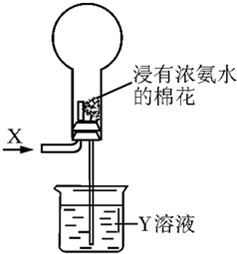

| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |
两种金属混合物共15g,投入足量的盐酸中,充分反应得1g H2,则原混合物组成中肯定不能为下列的( )
| A、Mg、Ag |
| B、Fe、Mg |
| C、Al、Cu |
| D、Mg、Al |
下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
| A、Mg2+、Na+、SO42-、Cl- |
| B、K+、CO32-、Cl-、NO3- |
| C、NH4+、Na+、SO42-、NO3- |
| D、Na+、K+、NO3-、SO32- |
下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
| A、热稳定性:Na2CO3>NaHCO3 |
| B、相同浓度溶液的碱性:Na2CO3>NaHCO3 |
| C、相同温度下在水中的溶解度:Na2CO3>NaHCO3 |
| D、相同条件下与酸反应的剧烈程度:Na2CO3>NaHCO3 |
已知:25℃时,KSP {Mg(OH)2}=5.61×l0-12,KSP {Co(OH)2}=1.09×l0-15.下列说法不正确的是( )
| A、25℃时,饱和Mg(OH)2溶液与饱和Co(OH)2溶液相比,前者的pH大 |
| B、25℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、25℃时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小 |
| D、25℃时,在Co(OH)2的悬浊液加入MgCl2溶液后,Co(OH)2可能转化成为Mg(OH)2 |
常温下两种溶液:①1mol?L-1的Na2CO3溶液,②1mol?L-1的NaHCO3溶液.下列对于这两种溶液的说法正确的是( )
| A、两种溶液中都存在:c(H+)?c(OH-)═1×10-14 |
| B、c(H2CO3):①>② |
| C、两种溶液中都存在:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) |
| D、向②溶液中加入等体积的1mol?L-1的NaOH溶液,②溶液可以变成①溶液 |
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
| A、气体A为SO2和H2的混合物 |
| B、反应中共消耗Zn 97.5 g |
| C、反应中共转移1.5 mol电子 |
| D、气体A中SO2和H2的体积比为1:4 |
下列关于有机物的性质的叙述正确的是( )
| A、蔗糖和麦芽糖都属于二糖,它们互为同分异构体 |
| B、乙烯和苯都不属于饱和烃,都能使酸性高锰酸钾溶液褪色 |
| C、金属钠与乙醇、乙酸都能反应产生氢气,是因为它们所含的官能团相同 |
| D、工业上经氧化、萃取等方法提取海水中的溴,萃取时可以使用裂化汽油等有机溶剂 |