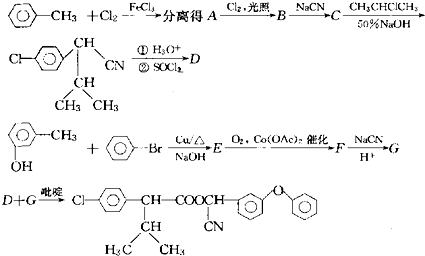
题目内容
食盐是重要调味品,随着对饮食健康的重视,出现了各种类型的特种食盐.
(1)常说“饮食过咸会伤骨”,长期摄入食盐过多可能导致骨骼脱钙,下列物质中,可以作为补钙药品主要成分的是 (填标号).
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)低钠盐因含有氯化钾和硫酸镁可防治高血压和心血管病,往其溶液中滴入氨水,发生反应的化学方程式是 .
(3)加硒盐中含有的硒元素是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一个实验事实: .
(4)加碘盐可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变蓝,1mol KIO3被还原时,转移电子 mol,该反应的离子方程式为 .
(1)常说“饮食过咸会伤骨”,长期摄入食盐过多可能导致骨骼脱钙,下列物质中,可以作为补钙药品主要成分的是
A.CaCO3 B.CaO C.Ca(OH)2 D.Ca
(2)低钠盐因含有氯化钾和硫酸镁可防治高血压和心血管病,往其溶液中滴入氨水,发生反应的化学方程式是
(3)加硒盐中含有的硒元素是人体微量元素中的“抗癌之王”,写出证明硒元素非金属性比硫元素弱的一个实验事实:
(4)加碘盐可防治碘缺乏症,其中的碘酸钾(KIO3)在酸性溶液中可氧化亚硫酸钠,生成物能使淀粉变蓝,1mol KIO3被还原时,转移电子
考点:微量元素对人体健康的重要作用,常见的食品添加剂的组成、性质和作用
专题:
分析:(1)补钙药品不能有腐蚀性;
(2)硫酸镁能与氨水反应生成氢氧化镁沉淀;
(3)利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应、与变价金属反应根据生成物质金属的价态高低等来判断非金属性的强弱;
(4)反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10.
(2)硫酸镁能与氨水反应生成氢氧化镁沉淀;
(3)利用非金属与氢气化合的难易程度、气态氢化物的稳定性、最高价氧化物的水化物的酸性、非金属单质之间的置换反应、与变价金属反应根据生成物质金属的价态高低等来判断非金属性的强弱;
(4)反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10.
解答:
解:(1)碳酸钙能与胃酸反应生成钙离子,用于补钙;氧化钙和氢氧化钙有腐蚀性,钙单质能与水反应生成氢氧化钙和氢气,故答案为:A;
(2)硫酸镁能与氨水反应生成氢氧化镁沉淀和硫酸铵:Mg SO4+2NH3?H2O=Mg (OH)2↓+(NH4)2SO4,故答案为:Mg SO4+2NH3?H2O=Mg (OH)2↓+(NH4)2SO4;
(3)硒与氢气化合比硫更难,或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒),故答案为:硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒等其它合理答案);
(4)反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,1mol KIO3被还原时,转移电子5mol;离子方程式为:2IO3-+5SO32-+2H+═I2+5SO42-+H2O,故答案为:5;2IO3-+5SO32-+2H+═I2+5SO42-+H2O.
(2)硫酸镁能与氨水反应生成氢氧化镁沉淀和硫酸铵:Mg SO4+2NH3?H2O=Mg (OH)2↓+(NH4)2SO4,故答案为:Mg SO4+2NH3?H2O=Mg (OH)2↓+(NH4)2SO4;
(3)硒与氢气化合比硫更难,或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒),故答案为:硒与氢气化合比硫更难(或硒酸酸性比硫酸弱,或硒化氢稳定性比硫化氢弱,或硫能置换出硒等其它合理答案);
(4)反应中S元素化合价由Na2SO3中+4价升高为+6价,总共升高2价,I元素化合价由KIO3中+5降低为I2中0价,总共降低10价,化合价最小公倍数为10,故Na2SO3系数为5,故I2系数为1,再结合原子守恒配平后方程式为5Na2SO3+2KIO3+H2SO4=5Na2SO4+K2SO4+I2+H2O,1mol KIO3被还原时,转移电子5mol;离子方程式为:2IO3-+5SO32-+2H+═I2+5SO42-+H2O,故答案为:5;2IO3-+5SO32-+2H+═I2+5SO42-+H2O.
点评:本题考查微量元素、非金属性比较、氧化还原反应的配平与计算等,难度中等,注意氧化还原反应中守恒思想的运用.

练习册系列答案
相关题目
用已经准确称量过的NaOH固体配制500mL1mol/L的NaOH溶液,供选择的仪器有:①玻璃棒②分液漏斗③胶头滴管④容量瓶⑤烧杯⑥烧瓶,必须选用的仪器有( )
| A、②③④ | B、①③④⑤ |
| C、③④⑤⑥ | D、①②④ |
下列变化(现象)的原理相同的是( )
| A、浓硫酸和浓盐酸敞口存放浓度均变小 |
| B、将单质铁和铜分别与单质硫加热反应均生成低价硫化物(FeS和Cu2S) |
| C、在过氧化氢水溶液中加入二氧化锰、在盛有锌粒和稀硫酸的溶液中滴加硫酸铜溶液,产生气体的速率均加快 |
| D、将氯化铝溶液和碳酸氢钠溶液分别用酒精灯加热蒸干,然后灼烧,最后均得到白色固体 |
下列关于有机物的说法错误的是( )
| A、CCl4可由CH4制得,可萃取碘水中的碘 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D、淀粉和纤维素的化学式都为(C6H10O5)n,但不是同分异构体 |
下列有关氮及其化合物的说法不正确的是( )
| A、硝酸应保存在棕色试剂瓶里 |
| B、铵态氮肥不宜与碱性肥料混合施用 |
| C、常温下铁、铝不与浓硝酸反应 |
| D、NO可用排水法收集,NO2可用向上排空气法收集 |
在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A、NH4+、HCO3ˉ、Clˉ、K+ |
| B、Clˉ、Na+、NO3ˉ、Ca2+ |
| C、K+、Fe2+、Clˉ、NO3ˉ |
| D、Cu2+、NH4+、SO42ˉ、Clˉ |
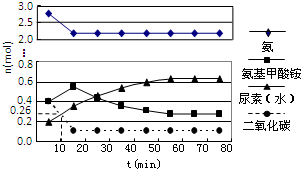 尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步:
尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应分为如下两步: