题目内容
2.古代造纸工艺中使用的某种物质存在副作用,它易导致纸张发生酸性腐蚀,使纸张变脆,易破损,该物质是( )| A. | 生石灰 | B. | 草木灰 | C. | 明矾 | D. | 漂白粉 |
分析 早期的纸张生产中,常采用纸表面涂敷明矾的工艺,人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存,原因是明矾中存在Al3+的水解产生氢离子,纤维素在酸性条件下能发生水解,据此解答.
解答 解:早期的纸张生产中,常采用纸表面涂敷明矾的工艺,明矾[KAl(SO4)2•12H2O]中铝离子水解,Al3++3H2O?Al(OH)3+3H+,产生氢离子,在酸性条件下纤维素水解,使高分子链断裂,所以纸质会变脆,破损,
故选:C.
点评 本题考查了盐类水解的性质和应用,明确明矾的成分及水解性质是解题关键,题目难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
12.化学与生产和生活密切相关,下列有关说法错误的是( )
| A. | 屠呦呦发现抗疟新药青蒿素而获得诺贝尔奖 | |
| B. | 氯气用作自来水的杀菌消毒剂 | |
| C. | 医用消毒酒精中乙醇的浓度(体积分数)为95% | |
| D. | 燃料不完全燃烧排放的CO是大气污染物之一 |
13.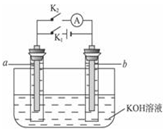 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
 如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图装置进行如下实验:断开K2,闭合K1一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| B. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| C. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
17.化学与社会、技术、环境、生活密切相关.下列有关说法中不正确的是( )
| A. | 高纯度的单晶硅用于制造光导纤维和登月车的光电池 | |
| B. | 石油裂解的主要目的是为了获得短链不饱和烃 | |
| C. | 按照分散质和分散剂所处的状态,可分为9种分散系 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或生物柴油 |
7.合成高分子化合物提高了人类的生活质量.下列说法正确的是( )
| A. | 涤纶、锦纶、蚕丝都属于合成纤维 | |
| B. | 塑料、液晶高分子和合成橡胶被称为三大合成材料 | |
| C. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 | |
| D. | 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物 |
12.设阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 常温常压下,22.4LH2O中含有的氢原子数为2NA | |
| B. | 17gNH3与18 g H2O所含有电子数均为10NA | |
| C. | 2.7 g Al与足量的NaOH溶液反应,生成H2的分子数为0.1NA | |
| D. | 1 mol HCl气体中的分子数与2L 0.5 mol/L盐酸中的溶质粒子数相等 |

 .
.