题目内容
常温下,已知稀盐酸的物质的量浓度为a mol/L,稀NaOH溶液的物质的量浓度为b mol/L,当两种溶液等体积混合时,所得溶液的pH=2(混合液体积为原体积的和),则a和b的关系为( )
A、a=
| ||
B、b=
| ||
| C、a=b+0.1 | ||
| D、a=b+0.02 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:盐酸和氢氧化钠都为强电解质,根据酸碱混合后溶液呈酸性,故H+过量,根据C(H+)=
来计算.
| n(H+)-n(OH-) |
| V酸+V碱 |
解答:
解:盐酸和氢氧化钠都为强电解质,酸碱混合后发生反应H++OH-=H2O,溶液呈酸性,故H+过量,设酸和碱的体积均为VL,混合后溶液中:C(H+)=
=
=10-2mol/L,
解得:a=b+0.02,
故选D.
| n(H+)-n(OH-) |
| V酸+V碱 |
| av-bv |
| 2v |
解得:a=b+0.02,
故选D.
点评:本题考查了酸碱混合后的pH的有关计算,明确混合后溶液显酸性、掌握公式的使用是关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1克氯气含有n个Cl2分子,则阿佛加德罗常数可表示为( )
| A、71n | ||
B、(
| ||
| C、35.5n | ||
D、(
|
将2.3g金属钠放入水中,要使每100个水分子中含有1个Na+,所需水的质量是( )
| A、91.8g |
| B、184g |
| C、181.8g |
| D、183.6g |
在某无色透明酸性溶液中,能共存的离子组是( )
| A、NH4+ NO3- Al3+ Cl- |
| B、Na+ CO32- K+ NO3- |
| C、MnO4- K+ SO42- Na+ |
| D、K+ SO42- HCO3- Na+ |
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L?s),10s后容器内B的物质的量浓度为( )
| A、1.6 mol/L |
| B、1.4 mol/L |
| C、3.2 mol/L |
| D、1.8 mol/L |
已知W2、X2、Y2、Z2四种物质的氧化能力Z2>X2>W2>Y2,判断下列氧化还原反应能发生的是( )
| A、2W-+Z2→2z-+W2 |
| B、2X-+W2→2W-+X2 |
| C、2X-+Y2→2Y-+X2 |
| D、2Z-+X2→2X-+Z2 |
如果a g某气体中含有该气体的分子数为b,则cg该气体在标准状况下的体积是(各选项中NA为阿伏加德罗常数的值)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
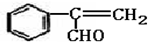 ,A及有机物的关系为:
,A及有机物的关系为: