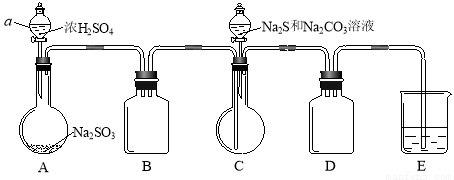题目内容
能用来区别NH4Cl、NaCl、Na2CO3三种物质的试剂(必要时可以加热)是
A、AgNO3溶液 B、稀硫酸 C、稀盐酸 D、Ba(OH)2溶液
D
【解析】
试题解析:氯离子、碳酸根离子都能和银离子反应生成白色沉淀,反应现象相同,所以无法鉴别,故A错误;稀硫酸与氯化铵氯化钠均不反应,均无明显变化,无法鉴别,故B错误;稀盐酸和氯化铵、氯化钠溶液不反应,所以现象相同,则无法鉴别,故C错误;氯化铵和氢氧化钡溶液反应生成有刺激性气味的氨气,碳酸根离子和钡离子反应生成碳酸钡白色沉淀,氯化钠和氢氧化钡不反应,所以三种溶液反应现象不同,所以可以鉴别,故D正确。
考点:物质的鉴别

温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g) N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol·L-1·s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D.T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
(12分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图:
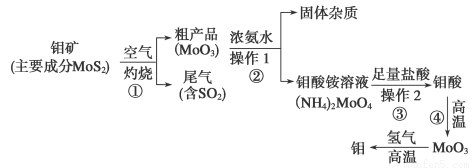
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O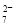 ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O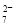 ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
加入NaOH溶液使溶液呈碱性,Cr2O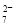 转化为CrO
转化为CrO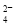 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。