题目内容
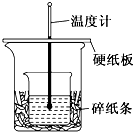 50ml 0.5mol?L-1的盐酸与50ml 0.55mol?L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.
50ml 0.5mol?L-1的盐酸与50ml 0.55mol?L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
(l)从实验装置上看,由图可知该装置有不妥之处,应如何改正?
(2)烧杯间填满碎纸条的作用是
(3)如果不盖硬纸板,求得的中和热数值
(4)实验中改用 60mL 0.50mol?L-1的盐酸跟 50mL 0.55mol?L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量
(5)用相同浓度和相同体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会
考点:中和热的测定
专题:实验设计题
分析:(1)应在最短的时间内让盐酸和氢氧化钠充分反应,所以应增添搅拌装置;为了测得温度的最高值,应加强保温、隔热和防止热量散失;
(2)中和热测定实验成败的关键是保温工作;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
(2)中和热测定实验成败的关键是保温工作;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(5)根据弱电解质电离吸热分析.
解答:
解:(1)为了测得温度的最高值,应在最短的时间内让盐酸和氢氧化钠充分反应,故缺少环形玻璃搅拌棒;为了测得温度的最高值,应加强保温、隔热和防止热量散失措施,应在在大小烧杯间填满碎泡沫(或纸条),并使小烧杯口与大烧杯口相平,
故答案为:增加环形玻璃搅拌棒、在大小烧杯间填满碎泡沫(或纸条)、使小烧杯口与大烧杯口相平;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;因为弱电解质的电离需要吸热.
故答案为:增加环形玻璃搅拌棒、在大小烧杯间填满碎泡沫(或纸条)、使小烧杯口与大烧杯口相平;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;
(4)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;因为弱电解质的电离需要吸热.
点评:本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
科学家发现世界上还存在着一种与C60相似的N60分子,它在高温或机械撞击下,其中积蓄的巨大能量会在一瞬间释放出来,对于N60的说法正确的是( )
| A、N60是N2的同素异形体 |
| B、N60的稳定性比N2差,熔沸点比N2低 |
| C、N60是原子晶体 |
| D、N60可能会成为很好的火箭材料 |
为了鉴别某白色纺织物成分是蚕丝还是人造丝,可以选用的方法是( )
| A、滴加浓盐酸 | B、滴加浓硫酸 |
| C、滴加酒精 | D、灼烧 |
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是( )
| A、所用NaOH已潮解 |
| B、向容量瓶加水时不慎超过了刻度线 |
| C、向容量瓶加水时眼睛一直俯视液面 |
| D、转移NaOH溶液后的烧杯没有洗涤 |

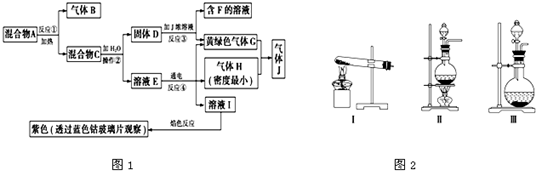
 在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.
在如图所示的物质转化关系中(反应条件已略去).A是海水中含量最多的盐,B是最常见的无色液体,D、E、F、H为单质.反应①是海水资源综合利用的重要反应,反应②常用于钢轨的焊接,工业上用C与D反应制备漂白液.