题目内容
(2012?天津)完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
分析:A.萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
B.苯酚易溶于乙醇;
C.碘单质易升华;
D.烧杯用来粗略配制溶液.
B.苯酚易溶于乙醇;
C.碘单质易升华;
D.烧杯用来粗略配制溶液.
解答:解:A.溴单质易溶于四氯化碳,且四氯化碳与水互不相溶,故A正确;
B.苯酚易溶于乙醇,不分层,不能用分液漏斗分离,故B错误;
C.加热后,碘单质易升华,剩余的是KI,故C错误;
D.烧杯用来粗略配制溶液,无法精确到0.0001,故D错误.
故选A.
B.苯酚易溶于乙醇,不分层,不能用分液漏斗分离,故B错误;
C.加热后,碘单质易升华,剩余的是KI,故C错误;
D.烧杯用来粗略配制溶液,无法精确到0.0001,故D错误.
故选A.
点评:本题考查萃取、分液、物质的分离、溶液的配制等,难度不大,注意萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应.

练习册系列答案
相关题目

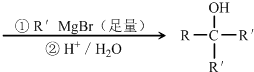


 +2NaOH
+2NaOH
 +NaBr+2H2O
+NaBr+2H2O
 (2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(2012?安徽)工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32-(aq)?PbCO3(s)+SO42-(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.


